
|
| 1.0×10-14 |
| 4.2×10-5 |
|
| 1.0×10-14 |
| 1.34×10-3 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、过氧化钠与水反应生成11.2L(标准状况下)氧气,反应中转移的电子数约为2NA |
| B、常温常压下,22.4L NO气体的分子数小于NA |
| C、常温常压下,0.5 mol?L-1的乙酸溶液中,乙酸分子的数目小于0.5NA |
| D、7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是合成某种手术用粘合剂的单体,X的合成路线如图:
)是合成某种手术用粘合剂的单体,X的合成路线如图:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
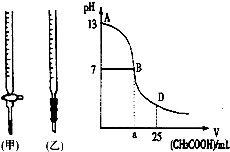 图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:
图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 甲基橙 | (乙) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com