
| ��� |
| �ŵ� |




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���20mL 0.2mol?L-1H2A��Һ�еμ� 0.2mol?L-1NaOH��Һ���й������ʵ����仯����ͼ�����Т����H2A�������HA-�������A2-���������ͼʾ��գ�
�����£���20mL 0.2mol?L-1H2A��Һ�еμ� 0.2mol?L-1NaOH��Һ���й������ʵ����仯����ͼ�����Т����H2A�������HA-�������A2-���������ͼʾ��գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c��Na+��=c��H2SO3��+c��HSO3-��+c ��H+�� |
| B��c��SO32-��+c��OH-��=c��H+��+c��H2SO3�� |
| C��c��Na+��+c��H+��=c��HSO3-��+c��SO32-��+c��OH-�� |
| D��c��Na+����c��HSO3-����c�� OH-����c��H2SO3����c��SO32-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�������ռ�ʱ������ʹ����ͨʯӢ������SiO2+2NaOH
| ||||
B�����ȵ���˿��ˮ�Ӵ��������γ�����ɫ�����ɫ�������㣺3Fe+4H2O
| ||||
| C����84����Һ������Ч�ɷ�NaClO���͡�����顱����Ҫ�ɷ����ᣩ���ʹ�÷ų�������ClO-+Cl-+2H+�TCl2��+H2O | ||||
| D���ں����ҵĽ���Һ������I-���еμ�H2O2�õ�I2��2I-+H2O2+2H+�TI2+O2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
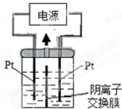
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3.2g����������������ȼ�գ�ת�Ƶĵ�����ĿΪ0.6NA |
| B���ں���1mol̼ԭ�ӵ�ʯī�����У��Ҽ���ĿΪ3NA |
| C����25��ʱ��1L pH=1��������Һ�к��е�OH-��ĿΪ1��10-13NA |
| D����2C��s��+O2��g���T2CO��g����H=-221kJ/mol������2NA������ת��ʱ��������Ӧ�ġ�H��Ϊ-110.5kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | A��g�� | B��g�� | C��g�� |
| ���ʵ���/mol | 1.2 | 0.6 | 0.6 |
| A����Ӧǰ20 s�ڵ�ƽ����Ӧ����Ϊv��A��=0.6 mol?L-1?s-1 |
| B��20 sʱ������Ӧ���ʴ����淴Ӧ���� |
| C���ﵽƽ��ʱ��A��g����ת����Ϊ100% |
| D���������¶�ƽ�ⳣ����Ϊ2����Ӧ�ġ�H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| ��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 |
| ��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com