
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是

A. 溶液中H+的物质的量
B. 溶液的导电能力
C. 溶液中的c(CH3COO-)/c(CH3COOH)
D. CH3COOH的电离程度
【答案】B
【解析】
A.醋酸在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加水稀释过程中电离平衡向右移动,溶液中H+的物质的量逐渐增大,与图像不符,y不表示H+的物质的量,A项错误;
CH3COO-+H+,加水稀释过程中电离平衡向右移动,溶液中H+的物质的量逐渐增大,与图像不符,y不表示H+的物质的量,A项错误;
B.电解质溶液的导电能力与溶液的离子浓度和离子所带电荷数成正比,加水稀释过程中,溶液的体积逐渐增大,醋酸的浓度逐渐减小,醋酸电离的阴、阳离子浓度逐渐减小,所以导电能力逐渐减小,符合图像,y可表示溶液的导电能力,B项正确;
C.加水稀释过程中:CH3COOH![]() CH3COO-+H+电离平衡向右移动,CH3COO-的物质的量逐渐增大,未电离的CH3COOH分子的浓度逐渐减小,故
CH3COO-+H+电离平衡向右移动,CH3COO-的物质的量逐渐增大,未电离的CH3COOH分子的浓度逐渐减小,故![]() 值逐渐增大,不符合图像,y不表示c(CH3COO-)/c(CH3COOH),C项错误;
值逐渐增大,不符合图像,y不表示c(CH3COO-)/c(CH3COOH),C项错误;
D.CH3COOH的电离程度=![]() ×100%,加水稀释过程中,醋酸的电离平衡CH3COOH
×100%,加水稀释过程中,醋酸的电离平衡CH3COOH![]() CH3COO-+H+向右移动,发生电离的醋酸分子数逐渐增大,所以电离程度逐渐增大,不符合图像,所以y不表示CH3COOH的电离程度,D项错误;答案选B。
CH3COO-+H+向右移动,发生电离的醋酸分子数逐渐增大,所以电离程度逐渐增大,不符合图像,所以y不表示CH3COOH的电离程度,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内v(N2)=0.2 mol·L-1·s-1,则3s末NH3的浓度为
A.0.4 mol·L-1B.0.6 mol·L-1C.0.9 mol·L-1D.1.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有K+、Na+、Cl﹣、CO32﹣、SO42﹣等离子,将该固体溶解于蒸馏水,对所得溶液进行如下实验:下列推断正确的是( )

A. 该混合物一定是K2CO3和NaCl
B. 该混合物可能是Na2CO3和KCl
C. 该混合物可能是Na2SO4和Na2CO3
D. 该混合物一定是K2SO4和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时(NH4)2CO3完全分解生成NH3、CO2和H2O,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的( )
A. 96倍B. 48倍C. 12倍D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
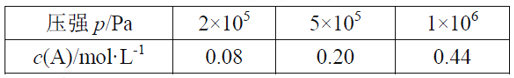
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com