
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸的反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
分析 A.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
B.离子方程式两边正电荷不相等;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.离子方程式两边负电荷不相等,不满足电荷守恒.
解答 解:A.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.钠与水的反应反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.铜片跟稀硝酸的反应生成硝酸铜、一氧化氮气体和水,正确的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故C错误;
D.金属铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
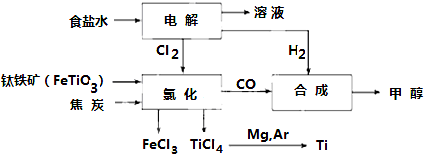
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com