
| A. | 可燃冰可能在未来汽车“燃油”替变为“燃冰” | |
| B. | 可燃冰即使开采不当也不会造成“温室效应” | |
| C. | 可燃冰中有一种甲烷气体,甲烷属无机物 | |
| D. | 可燃冰中的乙醚与乙醇互为同分异构体 |
分析 A.可燃冰燃烧释放能量,可能在未来汽车“燃油”替变为“燃冰”;
B.可燃冰的主要成分是甲烷,甲烷也是温室气体;
C.有机物是指含有碳元素的化合物,甲烷属有机物;
D.同分异构体是指分子式相同,但结构不同的化合物.
解答 解:A.“可燃冰”又称天然气水合物,它是在海底的高压低温条件下形成的,它的外观像冰,可燃冰的主要含成分是甲烷水合物(由甲烷和水组成),甲烷水合物的化学式为CH4•8H2O.可燃冰的主要成分甲烷完全燃烧生成二氧化碳和水,释放能量,可能在未来汽车“燃油”替变为“燃冰”,故A正确;
B.可燃冰的主要成分是甲烷,甲烷也是温室气体,所以如果可燃冰开采不当造成甲烷泄露,会加剧温室效应,故B错误;
C.甲烷是含有碳元素的化合物,属于有机物,故C错误;
D.乙醇和乙醚的分子式不同,分别为C2H6O、C4H10O,二者不是同分异构体,故D错误;
故选A.
点评 本题考查了可燃冰的知识,侧重于学生的分析能力和甲烷性质的考查,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | +260 | C. | +350 | D. | +130 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | Al2H6中铝的杂化方式为sp3杂化 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为三氧化二铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: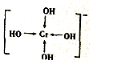 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂降低反应的活化能来提高化学反应效率 | |
| B. | 油脂和纤维素都属于高分子化合物 | |
| C. | 神州飞船的防护层中含聚四氯乙烯,合成它的单体属于卤代烃 | |
| D. | 中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com