
常温下用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,当阴极上生成的气体体积为0.112L时(标准状况),假设溶液体积不变,下列说法正确的是
A.阳极上产生0.025mol的O2
B.电解过程中总共转移0.2mol的 电子
电子
C.所得溶液中的c(H+)=0.3mol/L
D.阴极增重1.08g
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:实验题
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 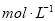 盐酸、6
盐酸、6 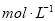 硫酸和蒸馏水)
硫酸和蒸馏水)

回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是___________________,装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是:___________________、 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
1mol•L﹣1硫酸溶液的含义是
A.1L水中含有1mol硫酸
B.1L溶液中含1mol H+
C.将98g硫酸溶于1L水所配成的溶液
D.指1L硫酸溶液中含有98g H2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:选择题
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示
CO(g)+H2(g);△H =+131.3kJ/mol表示
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量
C.1 mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量
D.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A .25% B.大于25% C.小于25% D.无法判断
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下,关于下列说法正确的是
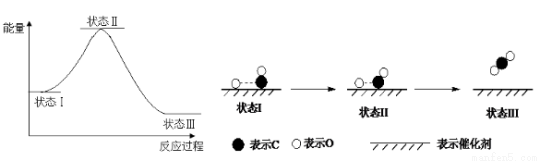
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
磷酸铁锂电池结构如右图所示。左边由LiFePO4晶体组成,铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质。在充电过程中LiFePO4中的锂离子脱出并伴随着铁元素的氧化。下列说法不正确的是

A.放电时,铝箔所在电极为负极,铜箔所在电极为正极
B.放电时,电池反应式为:FePO4+Li == LiFePO4
C.充电时, Li+向阴极移动
D.充电时,阳极的电极反应式为:LiFePO4 – e— == FePO4+Li+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列溶液中,c(H+)最大的是
A.0.1 mol/L HCl溶液 B.0.1 mol/L NaOH溶液
C.0.1 mol/L H2SO4溶液 D.0.1 mol/L CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:实验题
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10﹣10 | 5.0×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com