
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时![]() 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
【答案】(1)(2分) ④②③① ①
(2)(4分)c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—) 2.5×10—8
(3)(1分)减小 (4)(1分)大于
【解析】
试题分析:(1)硫酸是二元强酸,溶液显强酸性;碳酸氢钠溶液中HCO3-的水解程度强于HCO3-的电离程度,溶液显弱碱性;氯化铵溶于水NH4+水解,溶液显弱酸性;氢氧化钠是强碱,溶于水显强碱性,所以这4种溶液pH由大到小的顺序是④②③①;水是弱电解质,存在电离平衡H2O![]() H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大。硫酸中氢离子浓度大于氢氧化钠溶液中OH-浓度,所以硫酸溶液中由水电离的H+浓度最小,答案选①。
H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大。硫酸中氢离子浓度大于氢氧化钠溶液中OH-浓度,所以硫酸溶液中由水电离的H+浓度最小,答案选①。
(2)由于碳酸氢钠溶液中HCO3-的水解程度强于HCO3-的电离程度,溶液显弱碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—);根据水解方程式HCO3-![]() H2CO3+OH-可知,碳酸氢钠的水解常数Kh=
H2CO3+OH-可知,碳酸氢钠的水解常数Kh=![]() =
=![]() =
=![]() =
=![]() =2.5×10—8 mol·L-1。
=2.5×10—8 mol·L-1。
(3)氯化铵中存在水解平衡NH4++H2O![]() NH3·H2O+H+,向溶液中通入少量氨气,平衡向正反应方向越大,因此溶液中
NH3·H2O+H+,向溶液中通入少量氨气,平衡向正反应方向越大,因此溶液中![]() 的值减小。
的值减小。
(4)如果NH4Cl溶液和NaOH溶液等浓度、等体积混合后生成氯化钠和一水合氨,溶液显碱性。要使溶液显中性,则氯化铵应该是过量的,所以混合前③的体积大于④的体积。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
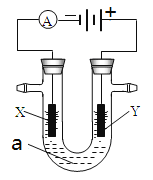
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是______________。在X极附近观察到的现象是______________________________。
②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___________________,电极反应式是______________。
②Y电极的材料是___________________,电极反应式是______________。
(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用以下装置制取并探究氨气的性质.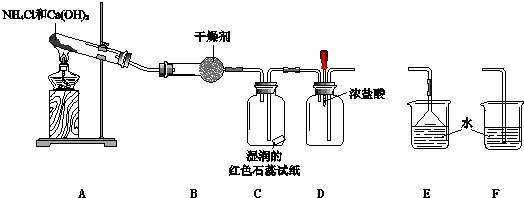
(1)A中反应的化学方程式是 .
(2)B中的干燥剂是 .
(3)C中的现象是 .
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1﹣2滴浓盐酸,可观察到的现象是 .
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是(填“E”或“F”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. 
(1)填写下列空白: ①试管A中的反应方程式为
②试管C中四氯化碳的作用是: . 反应开始后,观察D和E两试管,看到的现象分别为:D管 , E管 . 写出E中反应的离子方程式
③反应2~3min后,在B中的NaOH溶液里可观察到的现象是 . 原因
(2)实验室制备硝基苯的主要步骤如下: a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.请填写下列空白:
①制备硝基苯的反应类型是
②配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是: .
③步骤d中洗涤、分离粗硝基苯应使用的仪器是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.8g铝和镁的混合物粉末放入200mL盐酸中,恰好完全反应,并得到标准状况下8.96LH2 , 则:
(1)该合金中铝的物质的量为mol;
(2)该合金中镁的物质的量为g;
(3)盐酸的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学写出以下三个化学方程式(未配平)
(1)NO+HNO3→N2O3+H2O;
(2)NH3+NO→HNO2+H2O;
(3)N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是______,理由是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分子式为C4H8有机物最多存在4个C﹣C单键
B. ![]() 和
和![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个﹣CH2﹣,因此是同系物关系
分子组成相差一个﹣CH2﹣,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C﹣H键和C﹣O键的振动吸收,由此可以初步推测有机物结构简式为C2H5﹣OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.稀硫酸与氢氧化钡溶液混合:Ba2++SO ![]() +OH﹣+H+═H2O+BaSO4↓
+OH﹣+H+═H2O+BaSO4↓
B.Cl2通入水中:Cl2+H2O═H++Cl﹣+HClO
C.将钠加入硫酸铜溶液中的反应:2Na+2Cu2+═2Na++Cu
D.铜片投入稀硫酸中:Cu+2H+═Cu2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com