
| A. | 该反应为置换反应 | B. | 该晶体为分子晶体 | ||
| C. | 该物质是一种新的化合物 | D. | 该物质的相对分子质量是2400 |
分析 A.置换反应中应是单质与化合物反应生成单质和化合物;
B.根据题干信息科学界拟合成一种“双重结构”的球形分子解题;
C.混合物是由两种或两种以上物质组成的物质,化合物是由不同种元素组成的纯净物;
D.根据该分子是由60个碳原子和60个硅原子结合而成进行计算.
解答 解:A.把足球烯C60分子容纳在Si60分子中属于化合反应,故A错误;
B.该晶体是“双重结构”的球形分子,由分子构成的,属于分子晶体,故B正确;
C.由题中信息,该物质是由一种“二重构造”的球形分子构成的,该分子是由60个碳原子和60个硅原子结合而成,是由不同元素构成的纯净物,属于化合物,故C正确;D.该分子是由60个碳原子和60个硅原子结合而成,该物质的相对分子质量为2400,故D正确;
故选A.
点评 本题考查了置换反应、分子晶体等知识,题目难度不大,正确理解题给信息是解题关键,试题培养了学生分析、理解能力及灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )| A. | 构成原电池时b极反应为Cu2++2e-═Cu | |
| B. | 构成电解池时a极质量一定减少 | |
| C. | 构成电解池时b极质量可能减少也可能增加 | |
| D. | 构成的原电池或电解池工作后可能产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
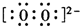 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化石燃料燃烧放出的热量使水分解制备氢气,是氢能开发的研究方向 | |
| B. | 石油的分馏和煤的干馏,都属于化学变化 | |
| C. | 向鸡蛋清的溶液中加入饱和(NH4)2SO4溶液,鸡蛋清因发生变性而析出 | |
| D. | 可利用二氧化碳制备全降解塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | Y氢化物的沸点一定比X氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | XZ2、XW4 与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在TZ2和TW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
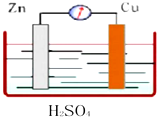 如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.
如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
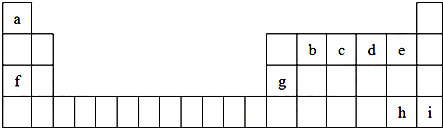
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素的原子间不能形成离子化合物 | |
| B. | 所有金属与所有非金属之间都能形成离子键 | |
| C. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com