
【题目】某混合物中含有KAl(SO4)2和另外两种金属氧化物,在一定条件下可实现下图所示物质间转化:
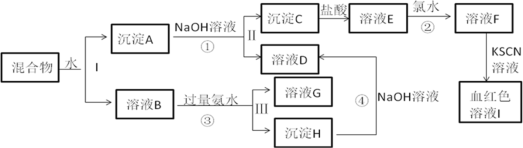
已知:Cl2+2Fe2+==2Fe3++2Cl-
请回答下列问题:
(1)沉淀H的化学式_________,框图中血红色物质是______(填化学式)
(2)Ⅰ、Ⅱ、Ⅲ分离操作中所需的玻璃仪器除烧杯、玻璃棒外还需要___________。
(3)反应①的离子方程式是____________。
(4)检验溶液G中金属阳离子的操作方法和现象是___________。
(5)若在E中加入KSCN溶液,溶液不变色,则沉淀C是________(填名称);
若在E中加入KSCN溶液,溶液变红色,为进一步确认沉淀C的成分,进行如下定量实验: 将沉淀C用5mol/L盐酸14mL恰好完全溶解,所得溶液还能吸收标准状况下56mL氯气,使其中Fe2+全部转化为Fe3+。则沉淀C可能的化学式是__________
【答案】Al(OH)3 Fe(SCN)3 漏斗 Al2O3 + 2OH- = 2AlO2- + H2O 焰色反应,隔蓝色的钴玻璃火焰呈紫色 氧化亚铁 Fe5O7
【解析】
(5)氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=
n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=![]() [n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式;
[n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式;
结合(5)的计算,沉淀A为Al2O3和Fe5O7,溶液B为KAl(SO4)2,B与氨水反应生成沉淀H为Al(OH)3,溶液G中含有:K2SO4、(NH4)2SO4;沉淀A为Al2O3和Fe5O7,加NaOH溶液,得溶液D为NaAlO2,沉淀C为Fe5O7,溶于盐酸生成溶液E,E为FeCl2、FeCl3的混合物,再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液F成分为FeCl3,血红色物质I是Fe(SCN)3。
(1)KAl(SO4)2与氨水反应生成Al(OH)3,沉淀H的化学式Al(OH)3,FeCl3与KSCN反应生成血红色物质I是Fe(SCN)3,框图中血红色物质是Fe(SCN)3,故答案为:Al(OH)3;Fe(SCN)3;
(2)Ⅰ、Ⅱ、Ⅲ分离操作是过滤,所需的玻璃仪器除烧杯、玻璃棒外还需要漏斗。故答案为:漏斗;
(3)反应①的离子方程式是Al2O3 + 2OH- = 2AlO2- + H2O。故答案为:Al2O3 + 2OH- = 2AlO2- + H2O;
(4)检验溶液G中金属阳离子为钾离子,检验的操作方法和现象是:焰色反应,隔蓝色的钴玻璃火焰呈紫色。故答案为:焰色反应,隔蓝色的钴玻璃火焰呈紫色;
(5)若在E中加入KSCN溶液,溶液不变色,则沉淀C是氧化亚铁(填名称);故答案为:氧化亚铁;
氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl)=
n(HCl)=![]() ×0.014L×5mol·L-1=0.035mol,,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=
×0.014L×5mol·L-1=0.035mol,,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=![]() [n(HCl)+2n(Cl2)]=
[n(HCl)+2n(Cl2)]=![]() ×(0.014L×5mol·L-1+2×
×(0.014L×5mol·L-1+2×![]() )=0.025mol,所以氧化物中n(Fe):n(O)=0.025mol:0.035mol=5:7,该氧化物的化学式为Fe5O7。
)=0.025mol,所以氧化物中n(Fe):n(O)=0.025mol:0.035mol=5:7,该氧化物的化学式为Fe5O7。
故答案为:Fe5O7。


科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
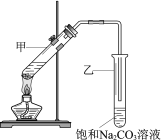
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
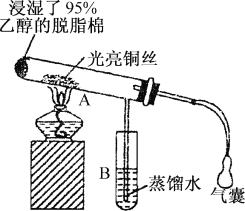
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ ![]() H2↑ + Cl2↑
H2↑ + Cl2↑
B. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3+ + 4NH3·H2O ═ AlO2-+ 4NH4+ + 2H2O
C. 苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O-→ 2C6H5OH + 2 CO32-
D. Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- ═ 5SO42-+ 2Mn2+ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( )
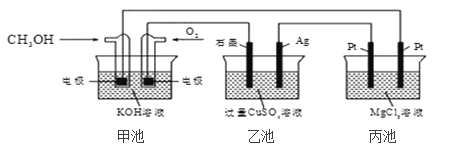
A. 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
B. 甲池通入 CH3OH 的电极反应式为 CH3OH+6e+2H2O═CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到原浓度
D. 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com