
分析 标况下22.4L氨气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,氮元素的最高价氧化物的水化物为硝酸,0.5L 1mol/L的硝酸溶液中含有硝酸的物质的量为:1mol/L×0.5L=0.5mol;1mol氨气与0.5mol硝酸反应,反应后得到等物质的量的NH3•H2O和NH4NO3的混合溶液,溶液显碱性,结合电荷守恒判断离子浓度大小顺序.
解答 解:标况下22.4L氨气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,
氮元素的最高价氧化物的水化物为硝酸,0.5L 1mol/L的硝酸溶液中含有硝酸的物质的量为:1mol/L×0.5L=0.5mol
1mol氨气与0.5mol硝酸反应生成0.5mol硝酸铵,还剩余0.5mol一水合氨,
即:反应后得到等物质的量的NH3•H2O和NH4NO3的混合溶液,一水合氨的电离程度大于铵根离子的水解程度,则溶液显碱性:c(OH-)>c(H+),结合电荷守恒可得:c(NH4+)>c(NO3-),
所以溶液中离子浓度大小顺序为:c(NH4+)>c(NO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(NO3-)>c(OH-)>c(H+).
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理等知识在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
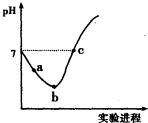
| A. | 实验过程中用pH试纸测定溶液的pH | |
| B. | a~b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com