
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
分析 对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题.
解答 解:A.对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,故A错误;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)?CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.Ⅱ浓度较大,Ⅲ温度较高,增大浓度平衡正向移动,升高温度平衡逆向移动,Ⅲ的转化率降低,Ⅲ中相当于起始C(H2)为Ⅱ的一半,平衡时Ⅱ中C(H2)小于Ⅲ中的两倍,故C错误;
D.对比Ⅰ、Ⅲ,Ⅲ温度较高,浓度相当,升高温度,反应速率增大,则容器Ⅲ中的反应速率比容器Ⅰ中的大,故D正确.
故选D.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响,涉及等效平衡问题,侧重于学生的分析能力的考查,题目难度中等,但易错,答题时注意把握反应的特点以及平衡的影响因素.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
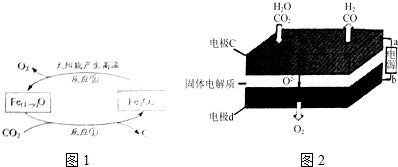
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
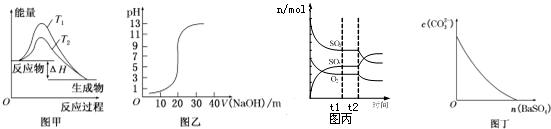
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
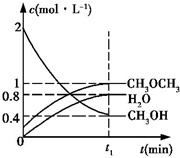 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3 | |
| B. | 500℃左右比常况下更有利于合成氨 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com