
���� ��1���ٸ��ݼ۲���ӶԻ���ģ���жϷ��ӿռ乹�ͣ���������ԭ�Ӽ۲���Ӷ����ж��ӻ���ʽ��
�ڸ��ݻ�ѧ����ʽ��������ĵ��������ʵ������ٸ���ÿ���������к���2���м����㣻
��2���ٷǽ�����Խǿ��Ԫ�أ�������Ԫ�صĽ������Խǿ�������⻯����ˮ��Һ�о�Խ�ѵ�⣬���Ծ�Խ�������ݼ۲���ӶԻ�������ȷ����̬SeO3���ӵ����幹�͡�SO32-���ӵ����幹�ͣ�
�ڸ�������Ԫ��Se�Ļ��ϼۿ����жϵ��Ըߵͣ�����Խ�ߣ���Se-O-H��Oԭ�ӵĵ�������Խǿ��Խ�����H+��
��� �⣺��1������NH3�����У���3��N-H������һ�Թµ��Ӷԣ����ݼ۲���ӶԻ���ģ���жϷ��ӿռ乹��Ϊ�����ͣ���N2H4�У���ԭ�Ӽ۲���Ӷ���Ϊ$\frac{5+3}{2}$=4�����Ե�ԭ�ӵ��ӻ���ʽΪsp3�ӻ����ʴ�Ϊ�������ͣ�sp3��
�ڷ�Ӧ����4mol N-H�����ѣ�����1molN2H4�μӷ�Ӧ�����ݻ�ѧ����ʽ��֪�����ĵ��������ʵ���Ϊ1.5mol����ÿ���������к���2���м��������γ�3mol�м����ʴ�Ϊ��3��
��2���ٷǽ�����Խǿ��Ԫ�أ�������Ԫ�صĽ������Խǿ�������⻯����ˮ��Һ�о�Խ�ѵ�⣬���Ծ�Խ�����ǽ�����S��Se������H2Se�����Ա�H2Sǿ��
��̬SeO3������Seԭ�Ӽ۲���ӶԸ�����3�Ҳ����µ��Ӷԣ����������幹��Ϊƽ�������Σ�
SO32-������Sԭ�Ӽ۲���ӶԸ���=3+$\frac{1}{2}$��6+2-3��2��=4�Һ���һ���µ��Ӷԣ����������幹��Ϊ�����Σ�
�ʴ�Ϊ��ǿ��ƽ�������Σ������Σ�
��H2SeO3��H2SeO4�ɱ�ʾ�ɣ�HO��2SeO�ͣ�HO��2SeO2��H2SeO3�е�SeΪ+4�ۣ���H2SeO4�е�SeΪ+6�ۣ������Ը��ߣ�����Se-O-H��O�ĵ��Ӹ���Seƫ�ƣ�Խ�����H+��H2SeO4��H2SeO3����ǿ��
�ʴ�Ϊ��H2SeO3��H2SeO4�ɱ�ʾΪ��HO��2SeO�ͣ�HO��2SeO2��H2SeO3�е�SeΪ+4�ۣ���H2SeO4�е�SeΪ+6�ۣ������Ը��ߣ�����Se-O-H��O�ĵ��Ӹ���Seƫ�ƣ��������H+��
���� ������Ҫ������ԭ�Ӻ�������Ų������ӿռ乹�͡�ԭ���ӻ���ʽ����ѧ���ļ����֪ʶ���ѶȲ���1��������ע��Է��ӽṹ�ķ�����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
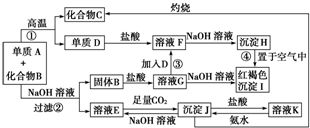

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2 | B�� | NaCl | C�� | H2S | D�� | NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2��C��Ӧ | B�� | Al��ϡ���ᷴӦ | ||
| C�� | CaCO3���ȷֽ� | D�� | Ba��OH��2?8H2O��NH4Cl���巴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | V1��1.12 V2��2.24 | B�� | Vl+V2��3.36 | ||
| C�� | ��Vl=1.12����V2��2.24 | D�� | ��V1��1.12����V2=2.24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ���ˮ��������������ʯ�ҳ���������ռ������ | |
| B�� | CCl4���Ҵ�������μ�ˮ������Һ����ˮ�� | |
| C�� | ������ϩ��������ˮ�������˳�ȥ���� | |
| D�� | �������������ᣩ���ӱ���̼������Һ���������Һ����ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��X��=0.2mol?L-1 | B�� | c��Y2��=0.35mol?L-1 | C�� | c��Y2��=0.2mol?L-1 | D�� | c��Z��=0.4mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������˫����ֱ���л��� | B�� | ��һ��������ֱ���л��� | ||
| C�� | ��һ��˫���Ļ�״�л��� | D�� | ֻ��һ��˫����ֱ���л��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=2��HA��Һ��pH=12��MOH��Һ����Ȼ�Ϻ���Һ������Ũ�ȹ�ϵ��c��H+��+c��M+��=c��OH-��+c��A-�� | |
| B�� | ���Ũ�ȵ�CH3COONa��NaOH��NaHCO3������Һ��pH��pH��CH3COONa����pH ��NaHCO3����pH��NaOH�� | |
| C�� | 0.1mol•L-1��NaHA��Һ����pH=4��c��Na+����c��HA-����c��H+����c��A2-����c ��H2A�� | |
| D�� | ���ʵ���Ũ�����CH3COOH��CH3COONa��Һ�������ϣ���Һ�����ԣ�c��CH3COO-����c��CH3COOH�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com