
”¾ĢāÄæ”æI”¢Ēėøł¾ŻČēĻĀĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµ»Ų“šÓŠ¹ŲĪŹĢā”£AŗĶB¾łĪŖÄĘŃĪµÄĖ®ČÜŅŗ£¬A³ŹÖŠŠŌ£¬B³Ź¼īŠŌ²¢¾ßÓŠĒæŃõ»ÆŠŌ”£
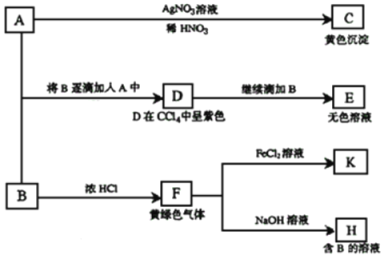
£Ø1£©Š“³öA”¢BµÄ»ÆѧŹ½£ŗA £¬B ”£
£Ø2£©ŅĄ“ĪŠ“³öA”śDŗĶD”śE£ØEÖŠŗ¬ÓŠÄ³+5¼ŪŌŖĖŲµÄŗ¬ŃõĖįøłĄė×Ó£©µÄĄė×Ó·½³ĢŹ½£ŗ £¬ ”£
£Ø3£©Š“³ö½«SO2ĘųĢåĶØČėKČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
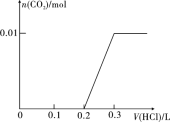
II”¢£Ø1£©½«0.4gNaOHŗĶ1.06gNa2CO3»ģŗĻ²¢Åä³ÉČÜŅŗ£¬ĻņČÜŅŗÖŠµĪ¼Ó0.1mol”¤L£1Ļ”ŃĪĖį”£ŌŚČēĻĀĶ¼ĖłŹ¾×ų±źĻµÖŠ»³öÄÜÕżČ·±ķŹ¾¼ÓČėŃĪĖįµÄĢå»żŗĶÉś³ÉCO2µÄĪļÖŹµÄĮæµÄ¹ŲĻµĶ¼Ļń”£

£Ø2£©½«18.4gNaOHŗĶNaHCO3¹ĢĢå»ģŗĻĪļ£¬ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČȵ½Ō¼250”ę£¬¾³ä·Ö·“Ó¦ŗóÅųöĘųĢ壬ĄäČ“£¬³ĘµĆŹ£Óą¹ĢĢåÖŹĮæĪŖ16.6g”£ŹŌ¼ĘĖć»ģŗĻĪļÖŠNaOHµÄÖŹĮæ·ÖŹż”££ØĒėŠ“³ö¼ĘĖć¹ż³Ģ£©
”¾“š°ø”æ¢ń£®£Ø1£©NaI£»NaClO£»
£Ø2£©2I+ClO+H2O=I2+Cl+2OH£» I2+5ClO+2OH=2IO3-+5Cl+H2O£Ø·“Ó¦ĪļŠ“Ė®µÄøų·Ö£©
£Ø3£©2Fe3++SO32-+2H2O=2Fe2++SO42-+4H+£Ø»ņ2Fe3++SO32-+H2O=2Fe2++SO42-+2H+£©£»
¢ņ£®£Ø1£©ČēĶ¼ĖłŹ¾
£Ø2£©54.3%”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ¢ń£®£Ø1£©ÓÉAÉś³ÉCµĆµ½»ĘÉ«³ĮµķAgI£¬æɵĆAÖŠŗ¬ÓŠI£¬ĒŅAĪŖÄĘŃĪ£¬¼“AĪŖNaI£»ÓÉBÓėÅØHCl·“Ӧɜ³ÉµÄF»ĘĀĢÉ«ĘųĢåĪŖĀČĘų£¬ĖłŅŌµĆBĪŖNaClO”££Ø2£©NaIÓėNaClO·¢ÉśŃõ»Æŗó·“Ó¦²śÉśµÄDŹ¹CCl4ČÜŅŗĻŌ×ĻÉ«£¬Ö¤Ć÷DŹĒI2£¬øł¾Żµē×ÓŹŲŗć”¢µēŗÉŹŲŗć¼°Ō×ÓŹŲŗćæɵĆA”śDµÄĄė×Ó·½³ĢŹ½ĪŖ2I+ClO+H2O=I2+Cl+2OH£»Ļņŗ¬ÓŠI2µÄČÜŅŗÖŠ¼ĢŠų¼ÓČėNaClOČÜŅŗ£¬»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬½«I2Ńõ»ÆĪŖĪŽÉ«µÄIO3-£¬øł¾Żµē×ÓŹŲŗć”¢µēŗÉŹŲŗć¼°Ō×ÓŹŲŗćæɵĆD”śEµÄĄė×Ó·½³ĢŹ½ĪŖI2+5ClO+ 2OH =2IO3-+5Cl+H2O£»£Ø3£©FŹĒCl2£¬½«ĀČĘųĶØČėµ½FeCl2ČÜŅŗÖŠ£¬·¢Éś·“Ó¦£ŗCl2+2FeCl2=2FeCl3£¬ĖłŅŌKŹĒFeCl3£¬FeCl3¾ßÓŠŃõ»ÆŠŌ£¬SO2¾ßÓŠ»¹ŌŠŌ£¬¶žÕß·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ĖłŅŌSO2ĘųĢåĶØČėKČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ2Fe3++SO32-+H2O=2Fe2++SO42-+2H+”£
¢ņ£®£Ø1£©0.4g NaOHµÄĪļÖŹµÄĮæĪŖn(NaOH)=m”ĀM=0.4g”Ā40g/mol=0.01mol£¬1.06g Na2CO3µÄĪļÖŹµÄĮæĪŖn(Na2CO3)= m”ĀM=0.01mol£¬Į½Õß»ģŗĻ²¢Åä³ÉČÜŅŗ£¬ĻņČÜŅŗÖŠµĪ¼Ó0.1mol”¤L1Ļ”ŃĪĖį£¬Ź×ĻČ·¢ÉśNaOH+ HCl=NaCl+H2O”¢ĻūŗÄHCl 0.01mol£¬Č»ŗó·¢ÉśNa2CO3+HCl=NaHCO3+NaCl£¬ĻūŗÄHCl 0.01mol£¬×īŗó·¢ÉśNaHCO3+HCl=NaCl+CO2”ü+H2O£¬ĻūŗÄHCl 0.01mol£¬¾ŻÉĻŹöŹż¾Ż£¬æÉ»³öŃĪĖįµÄĢå»żŗĶÉś³ÉCO2µÄĪļÖŹµÄĮæµÄ¹ŲĻµĶ¼ĻóŹĒ
 ӣ
ӣ
£Ø2£©ČōÉčNaOHŗĶNaHCO3°“1”Ć1·“Ó¦£ŗ
NaHCO3+NaOH ![]() Na2CO3+H2O”ü ”÷m
Na2CO3+H2O”ü ”÷m
84 40 18
8.4g 4.0g 18.4g16.6g=1.8g
8.4g+4.0g=12.4g£¼18.4g£¬ĖµĆ÷·“Ó¦²»ŹĒ°“ÉĻŹö±ČĄż½ųŠŠ·“Ó¦”£
ČōNaHCO3¹żĮ棬ÓÉÓŚŹÜČČ»į·¢Éś·Ö½ā£¬Ęä²īÖµ»¹»įŌö“ó”£ÓėĢāŅā²»·ū”£
ČōNaOH¹żĮ棬ÓÉÓŚŹÜČČ²»»į·Ö½ā£¬²»Ó°ĻģĘä²īÖµ£¬·ūŗĻĢāŅā”£
¹żĮæµÄNaOHÖŹĮæĪŖ18.4g8.4g4g=6.0g£¬m(NaOH)=4.0g+6.0g=10.0g£¬¹ŹNaOHµÄÖŹĮæ·ÖŹż=(10.0g”Ā18.4g)”Į100%=54.3%”£


 ÄĻ“ó½ĢøØĒĄĻČĘšÅÜŹī¼ŁĻĪ½Ó½Ģ³ĢÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ÄĻ“ó½ĢøØĒĄĻČĘšÅÜŹī¼ŁĻĪ½Ó½Ģ³ĢÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
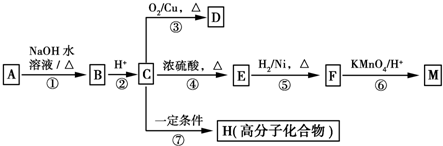
”¾ĢāÄæ”æÓŠ»śĪļA”«MÓŠČēĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµ£¬AÓėF·Ö×ÓÖŠĖłŗ¬Ģ¼Ō×ÓŹżĻąĶ¬£¬ĒŅ¾łÄÜÓėNaHCO3ČÜŅŗ·“Ó¦£¬FµÄ·Ö×ÓŹ½ĪŖC9H10O2£¬ĒŅ²»ÄÜŹ¹äåµÄCCl4ČÜŅŗĶŹÉ«£¬DÄÜ·¢ÉśŅų¾µ·“Ó¦£¬MÓė×ćĮæµÄNaOHČÜŅŗ·“Ó¦ŗóµÄ²śĪļ£¬ĘäŅ»ĀČ“śĪļÖ»ÓŠŅ»ÖÖ”£
¼ŗÖŖ£ŗ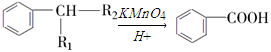 £ØR1”¢R2±ķŹ¾Ģž»ł»ņĒāŌ×Ó£©
£ØR1”¢R2±ķŹ¾Ģž»ł»ņĒāŌ×Ó£©
Ēė»Ų“š£ŗ
£Ø1£©BµÄ½į¹¹¼ņŹ½ĪŖ_________”£
£Ø2£©·“Ó¦¢Ł”«¢ßÖŠ£¬ŹōÓŚŃõ»Æ·“Ó¦µÄŹĒ_______________£ØĢī·“Ó¦ŠņŗÅ£©”£
£Ø3£©Š“³ö·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½______________________”£
£Ø4£©DÓėŠĀÖĘCu (OH)2Šü×ĒŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______________________”£
£Ø5£©AµÄĻą¶Ō·Ö×ÓÖŹĮæŌŚ180”«260Ö®¼ä£¬“ÓŅŌÉĻ×Ŗ»ÆÖŠ²»ÄÜČ·ČĻAµÄijŅ»¹ŁÄÜĶÅ£¬ĻĀĮŠČ·¶ØøĆ¹ŁÄÜĶŵÄÄÄŠ©ŹµŃé·½·ØŹĒÕżČ·µÄ______________”£
A£®Č”ÉŁĮæAÓŚŹŌ¹ÜÖŠ£¬ŌŁ¼ÓČė±½Õńµ“£¬¹Ū²ģ·ÖŅŗŗóÉĻ²ćČÜŅŗŃÕÉ«
B£®Č”ÉŁĮæAÓŚŹŌ¹ÜÖŠ£¬ŌŁ¼ÓČėNaOHČÜŅŗ¹²ČČ£¬“żĄäČ“ŗó¼ÓČėĻ”ĻõĖįµ÷½ŚÖĮĖįŠŌ£¬×īŗóµĪČėAgNO3ČÜŅŗ£¬¹Ū²ģ³ĮµķŃÕÉ«
C£®Č”ÉŁĮæAÓŚŹŌ¹ÜÖŠ£¬ŌŁµĪČėAgN03ČÜŅŗ£¬ŌŁ¼ÓČėĻ”ĻõĖį£¬¹Ū²ģ³ĮµķŃÕÉ«
D£®Č”ÉŁĮæAÓŚŹŌ¹ÜÖŠ£¬ŌŁ¼ÓČėNaOHµÄ“¼ČÜŅŗ¹²ČČ£¬“żĄäČ“ŗó¼ÓČėĻ”ĻõĖįµ÷½ŚÖĮĖįŠŌ£¬×īŗóµĪČėAgNO3Ō”Ņŗ£¬¹Ū²ģ³ĮµķŃÕÉ«
£Ø6£©·ūŗĻĻĀĮŠĢõ¼žµÄFµÄĶ¬·ÖŅģ¹¹Ģå¹²ÓŠ____________ÖÖ”£
A£®ÄÜ·¢ÉśŅų¾µ·“Ó¦
B£®ÄÜÓėFeC13ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦
C£®ŗĖ“Ź²ÕńĒāĘ×ÉĻÓŠĖÄøö·å£¬Ęä·åĆ껿֮±ČĪŖ1:1:2:6
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ÓĆ0.1molL-1HClČÜŅŗµĪ¶Ø10.0mLÅضČĪŖ0.1molL-1Na2CO3ČÜŅŗ£¬ĖłµĆµĪ¶ØĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĪ¢Į£ÅØ¶Č“óŠ”¹ŲĻµÕżČ·µÄŹĒ
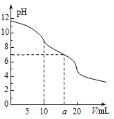
A£®µ±V=0Ź±£ŗc(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B£®µ±V=5Ź±£ŗc(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C£®µ±V=10Ź±£ŗc(Na+)£¾c(HCO3-)£¾c(CO32-)£¾c(H2CO3)
D£®µ±V=aŹ±£ŗc(Na+)=c(Cl-)£¾c(H+)=c(OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠ½šŹōµ„ÖŹA”¢B”¢CŗĶĘųĢåŅŅ”¢±ū¼°ĪļÖŹD”¢E”¢F”¢G”¢H£¬ĖüĆĒÖ®¼ä·¢ÉśČēĻĀ·“Ó¦£ØĶ¼ÖŠÓŠŠ©·“Ó¦µÄ²śĪļŗĶ·“Ó¦µÄĢõ¼žĆ»ÓŠČ«²æ±ź³ö£©”£
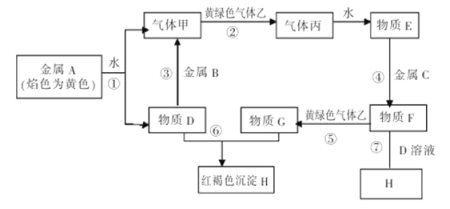
Ēėøł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĪļÖŹFµÄ»ÆѧŹ½ĪŖ ”£
£Ø2£©Ėµ³ö»ĘĀĢÉ«ĘųĢåŅŅµÄŅ»ÖÖÓĆĶ¾ ”£
£Ø3£©Ēų±šE”¢FĮ½ÖÖČÜŅŗ×ī¼ņµ„µÄ·½·ØŹĒ £¬ŹµŃéŹŅ¼ģŃéGÖŠĖłŗ¬µÄ½šŹōĄė×ÓŹ±£¬³£ŌŚGµÄČÜŅŗÖŠ¼ÓČė ČÜŅŗ”£
£Ø4£©·“Ó¦¢ŁµÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø5£©ĪļÖŹF”śHµÄ×Ŗ»ÆŠč¾¹żĮ½øöĮ¬Šų½ųŠŠµÄ·“Ó¦£¬ĒėŠ“³öÕāĮ½øö·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ ”¢ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放»Æѧ”Ŗ”ŖŃ”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“””æ
øß·Ö×Ó»ÆŗĻĪļHµÄŗĻ³ÉĀ·ĻßČēĻĀĶ¼ĖłŹ¾£ŗ

£Ø1£©AµÄĆū³ĘŹĒ £¬ÓÉAÉś³ÉBµÄ·“Ó¦ĄąŠĶŹĒ ”£
£Ø2£©CµÄ½į¹¹¼ņŹ½ĪŖ £¬FÖŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ ”£
£Ø3£©Š“³öÓÉEÉś³ÉMµÄ»Æѧ·½³ĢŹ½£ŗ ”£
£Ø4£©ŌŚ“߻ƼĮ“ęŌŚĻĀ£¬D”¢G°“ĪļÖŹµÄĮæÖ®±ČĪŖ1:1·¢Éś¼Ó¾Ū·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø5£©QŹĒMµÄŅ»ÖÖĶ¬ĻµĪļ£¬Ļą¶Ō·Ö×ÓÖŹĮæ±ČM“ó14£¬QÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬Ōņ·ūŗĻĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹Ģå¹²ÓŠ ÖÖ”£
¢ŁÄÜÓė½šŹōÄĘ·¢ÉśÖĆ»»·“Ó¦£»¢ŚÄÜ·¢ÉśŅų¾µ·“Ó¦”£Š“³öĘäÖŠŗĖ“Ź²ÕńĒāĘ×ÓŠ4×é·åµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠŗ¬ÓŠĻĀĮŠĮłÖÖĄė×Ó£ŗ¢ŁHCO3©¢ŚSO32©¢ŪNa+¢ÜCO32©¢ŻNH4+¢ŽNO3©£¬ĻņĘäÖŠ¼ÓČėŅ»¶ØĮæNa2O2ŗó£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č»ł±¾±£³Ö²»±äµÄŹĒ£Ø £©
A. Ö»ÓŠ¢Ž B. ¢Ü¢Ž C. ¢Ū¢Ü¢Ž D. ¢Ł¢Ś¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞Ńõ»Æīę(CeO2)ŹĒŅ»ÖÖÖŲŅŖµÄĻ”ĶĮŃõ»ÆĪļ”£ŅŌ·śĢ¼īęæó(Ö÷ŅŖŗ¬CeFCO3)ĪŖŌĮĻÖʱøCeO2µÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
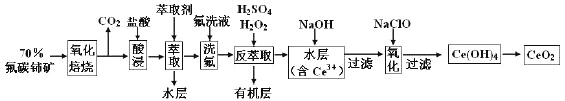
ŅŃÖŖ£ŗ¢ŁCe4£«¼ČÄÜÓėF£½įŗĻ³É[CeFx](4£x)£«£¬Ņ²ÄÜÓėSO42£½įŗĻ³É[CeSO4]2£«£»
¢ŚŌŚĮņĖįĢåĻµÖŠCe4£«Äܱ»ŻĶČ”¼Į[(HA)2]ŻĶČ”£¬¶ųCe3£«²»ÄÜ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©”°Ńõ»Æ±ŗÉÕ”±Ē°Šč½«æóŹÆ·ŪĖé³ÉĻøæÅĮ££¬ĘäÄæµÄŹĒ__________________________”£
£Ø2£©”°Ėį½ž”±ÖŠ»į²śÉś“óĮæ»ĘĀĢÉ«ĘųĢ壬Š“³öCeO2ÓėŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________________________________£»ĪŖ±ÜĆā²śÉśÉĻŹöĪŪČ¾£¬ĒėĢį³öŅ»ÖÖ½ā¾ö·½°ø£ŗ________”£
£Ø3£©”°ŻĶČ””±Ź±“ęŌŚ·“Ó¦£ŗCe4£«£«n(HA)2 ![]() Ce”¤(H2n£4A2n)£«4H£«”£ŹµŃéŹŅÖŠŻĶČ”Ź±ÓƵ½µÄÖ÷ŅŖ²£Į§ŅĒĘ÷Ćū³ĘĪŖ___________£» ____________________________________________________________”£
Ce”¤(H2n£4A2n)£«4H£«”£ŹµŃéŹŅÖŠŻĶČ”Ź±ÓƵ½µÄÖ÷ŅŖ²£Į§ŅĒĘ÷Ćū³ĘĪŖ___________£» ____________________________________________________________”£
£Ø4£©”°·“ŻĶČ””±ÖŠ£¬ŌŚĻ”ĮņĖįŗĶH2O2µÄ×÷ÓĆĻĀCeO2×Ŗ»ÆĪŖCe3+£¬H2O2ŌŚøĆ·“Ó¦ÖŠ×÷_________(Ģī”°“߻ƼĮ”±”¢”°Ńõ»Æ¼Į”±»ņ”°»¹Ō¼Į”±)£¬ĆæÓŠ1mol H2O2²Ī¼Ó·“Ó¦£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ________________”£
£Ø5£©”°Ńõ»Æ”±²½ÖčµÄ»Æѧ·½³ĢŹ½ĪŖ________________________________”£
£Ø6£©Č”ÉĻŹöĮ÷³ĢÖŠµĆµ½µÄCeO2²śĘ·0£®4500g£¬¼ÓĮņĖįČܽāŗó£¬ÓĆ0£®1000mol/LFeSO4±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµćŹ±(īę±»»¹ŌĪŖCe3+£¬ĘäĖüŌÓÖŹ¾ł²»·“Ó¦)£¬ĻūŗÄ25£®00mL±ź×¼ČÜŅŗ”£øĆ²śĘ·ÖŠCeO2µÄÖŹĮæ·ÖŹżĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗ
C(½šøÕŹÆ£¬s)£«O2(g)===CO2(g)””¦¤H1
C(ŹÆÄ«£¬s)£«O2(g)===CO2(g)””¦¤H2
C(ŹÆÄ«£¬s)===C(½šøÕŹÆ£¬s)””¦¤H3£½£«1.9 kJ”¤mol£1
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A£®ŹÆÄ«×Ŗ»Æ³É½šøÕŹÆµÄ·“Ó¦ŹĒĪüČČ·“Ó¦
B£®½šøÕŹÆ±ČŹÆÄ«ĪȶØ
C£®¦¤H3£½¦¤H1£¦¤H2
D£®¦¤H1>¦¤H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·ŪĆŗ»ŅŹĒČ¼Ćŗµē³§µÄ·ĻŌü£¬Ö÷ŅŖ³É·ÖĪŖSiO2”¢Al2O3”¢Fe2O3ŗĶCµČ”£ŹµŃéŹŅÄ£Äā¹¤Ņµ“Ó·ŪĆŗ»ŅĢįČ”»īŠŌAl2O3£¬ĘäĮ÷³ĢČēĻĀĶ¼£ŗ

ŅŃÖŖÉÕ½į¹ż³ĢµÄ²śĪļÖ÷ŅŖŹĒ£ŗNaAlO2”¢Ca2SiO4”¢NaFeO2ŗĶNa2SiO3µČ”£
£Ø1£©Š“³öÉÕ½į¹ż³ĢÖŠĀĮŌŖĖŲ×Ŗ»ÆµÄ»Æѧ·½³ĢŹ½ ”£
£Ø2£©²Ł×÷aĪŖĄäČ“”¢ŃŠÄ„£¬ĘäÖŠŃŠÄ„µÄÄæµÄŹĒ ”£
£Ø3£©½ž³ö¹ż³ĢÖŠ£¬NaFeO2æÉĶźČ«Ė®½ā£¬Ė®½ā·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©²Ł×÷bµÄĆū³ĘŹĒ £¬ĖłÓĆµÄ²£Į§ŅĒĘ÷ÓŠ ”¢ ŗĶÉÕ±”£
£Ø5£©”°Ģ¼»Æ”±Ź±Éś³É³Įµķ£¬³ĮµķµÄ»ÆѧŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com