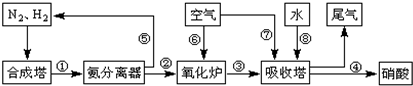
��ҵ�ϳɰ����Ʊ�����һ��������������������£�

��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO+H
2O��g��?CO
2+H
2��t��ʱ����1L�ܱ������г���0.2mol CO��0.3molˮ��������Ӧ����ƽ�����ϵ��c��H
2��=0.12mol?L
-1�����¶��´˷�Ӧ��ƽ�ⳣ��K=
1
1
�������������
�ڱ����¶Ȳ��䣬������ƽ����ϵ���ټ���0.1molCO������Ӧ���½���ƽ��ʱ��ˮ������ת���ʦ���H
2O��=
50%
50%
��
��2���ϳ����з�����ӦN
2��g��+3H
2��g��?2NH
3��g������H��0���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����ɴ˿���֪������
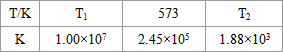
T
1��
��
573K�����������������=������

��3��NH
3��O
2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH
3��g��+5O
2��g��?4NO��g��+6H
2O��g����H=-905kJ?mol
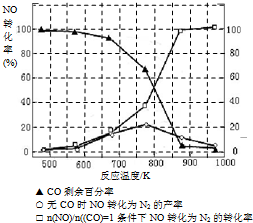
-1����ͬ�¶���NO��������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½���ԭ��
�¶ȸ���900��ʱ��ƽ�������ƶ�
�¶ȸ���900��ʱ��ƽ�������ƶ�
��
��4����ˮ�е�N��PԪ�������ˮ�帻Ӫ�����Ĺؼ����أ�ũҩ���ŷŵķ�ˮ�г����н϶��NH
4+��PO
43-��һ�����ͨ�����ַ��������ȥ��
�ٷ���һ����Ca��OH��
2��CaO Ͷ�ӵ��������ķ�ˮ�У���������ƣ��Ӷ����л��գ���������ķ�ˮ��c��Ca
2+��=2��10
-7 mol/Lʱ����Һ��c��PO
43-��=
5��10-7
5��10-7
mol/L��
����֪K
sp[Ca
3��PO
4��
2]=2��10
-33��
�ڷ��������ڷ�ˮ�м���þ��ҵ��ˮ���Ϳ������ɸ�Ʒλ����ʯ-���ʯ����Ӧ�ķ���ʽΪMg
2++NH
4++PO
43-=MgNH
4PO
4�����÷�������Ҫ������ˮ��pHΪ7.5��10����pH����10.7�����ʯ�IJ������ͣ���ԭ�����Ϊ
��pH����10.7ʱ����Һ�е�Mg2+��NH4+����OH-��Ӧ��ƽ�����淴Ӧ�����ƶ�
��pH����10.7ʱ����Һ�е�Mg2+��NH4+����OH-��Ӧ��ƽ�����淴Ӧ�����ƶ�
���뷽��һ��ȣ����������ŵ�Ϊ
��ͬʱ��ȥ��ˮ�еĵ������������þ��ҵ��ˮ
��ͬʱ��ȥ��ˮ�еĵ������������þ��ҵ��ˮ
��

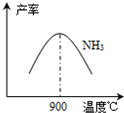





 ��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1����ͬ�¶���NO��������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½���ԭ��
��3��NH3��O2�ڲ�ϵ���������´�145��Ϳ�ʼ��Ӧ��4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H=-905kJ?mol-1����ͬ�¶���NO��������ͼ��ʾ���¶ȸ���900��ʱ��NO�����½���ԭ��
 ��3��N2��H2���������������´�145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3������ͼ��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ��
��3��N2��H2���������������´�145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3������ͼ��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ��