
| A. | 氢气 | B. | 二氧化碳 | C. | 氧气 | D. | 氮气 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
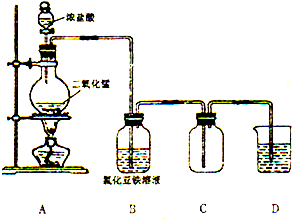 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水反应实质是Al3++4NH3•H2O═AlO2-+4NHO${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的①NH4C1、②(NH4)2S04、③NH4HS04溶液中,c(NH4+)的大小顺序:②>③>① | |
| B. | 0.2 mol•L-1CH3COOH溶液和0.2 mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(HSO3-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com