
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。
请回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________。
③FeCl3净水的原理是:_________________(用离子方程式及适当文字回答);FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是_________(用离子方程式表示)。
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
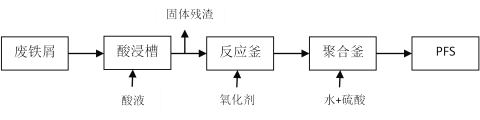
①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择____________________(填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________(填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
(3)废铁屑在一定条件下,可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,维持电流强度为1A,a电池工作1小时,理论上消耗FeS2__________g。(已知1mol电子的电量为96500C)
【答案】 ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 2 Fe3++3H2O![]() 3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 硫酸 d a ac 1.1g
3H++Fe(OH)3,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 硫酸 d a ac 1.1g
【解析】(1)本题考查氧化反应方程式的配平、pH的计算、盐类水解等知识,①利用ClO3-的强氧化性,把Fe2+氧化成Fe3+,本身被还原成Cl-,利用化合价的升降法进行配平,即ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O ;②根据电荷守恒,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-),代入数值,2×2×10-2+3×10-3+c(H+)=5.3×10-2,解得c(H+)=1×10-2mol·L-1,因此pH=2;③FeCl3净水,利用Fe3+的水解:Fe3++3H2O ![]() Fe(OH)3+3H+,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;钢铁成分是Fe,与FeCl3发生:Fe+2Fe3+=3Fe2+;(2)考查化学工艺流程,①流程制备的是聚合硫酸铁,为了不引入新杂质,因此最适合的酸是硫酸;②a、容易引入NO3-,故a错误;b、KMnO4作氧化剂,被还原成Mn2+,引入新杂质,故b错误;c、使用氯气,引入Cl-,故c错误;d、H2O2作氧化剂,被还原成H2O,不引入杂质,故d正确;检验Fe2+是否完全被氧化,需要检验Fe2+是否存在,需要用K3[Fe(CN)6] 溶液,进行检验,如果出现蓝色沉淀,说明Fe2+没有被完全氧化,故a正确;③a、加入NaHCO3,HCO3-消耗H+,减少生成物的浓度,平衡向正反应方向进行,故a正确;b、此反应属于盐类水解,盐类水解是吸热反应,降温,平衡向逆反应方向进行,故b错误;c、加水稀释,离子浓度降低,平衡向正反应方向进行,故c正确;d、加入NH4Cl,对此平衡的移动不产生影响,故d错误;(3)本题考查电化学的计算,根据电池总反应,正极反应式为FeS2+4e-=Fe+2S2-,维持电流强度为1A,电池工作1小时,因此转移电子的物质的量为3600/36500mol,因此消耗的FeS2的质量为120×3600/(4×96500)g=1.1g。
Fe(OH)3+3H+,水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;钢铁成分是Fe,与FeCl3发生:Fe+2Fe3+=3Fe2+;(2)考查化学工艺流程,①流程制备的是聚合硫酸铁,为了不引入新杂质,因此最适合的酸是硫酸;②a、容易引入NO3-,故a错误;b、KMnO4作氧化剂,被还原成Mn2+,引入新杂质,故b错误;c、使用氯气,引入Cl-,故c错误;d、H2O2作氧化剂,被还原成H2O,不引入杂质,故d正确;检验Fe2+是否完全被氧化,需要检验Fe2+是否存在,需要用K3[Fe(CN)6] 溶液,进行检验,如果出现蓝色沉淀,说明Fe2+没有被完全氧化,故a正确;③a、加入NaHCO3,HCO3-消耗H+,减少生成物的浓度,平衡向正反应方向进行,故a正确;b、此反应属于盐类水解,盐类水解是吸热反应,降温,平衡向逆反应方向进行,故b错误;c、加水稀释,离子浓度降低,平衡向正反应方向进行,故c正确;d、加入NH4Cl,对此平衡的移动不产生影响,故d错误;(3)本题考查电化学的计算,根据电池总反应,正极反应式为FeS2+4e-=Fe+2S2-,维持电流强度为1A,电池工作1小时,因此转移电子的物质的量为3600/36500mol,因此消耗的FeS2的质量为120×3600/(4×96500)g=1.1g。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为________________________;
(2)AB32-的立体构型是____________,其中A原子的杂化轨道类型是___________________________。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为________________,1molB22+中含有的π键数目为________________________。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键___________________。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是_________________(只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
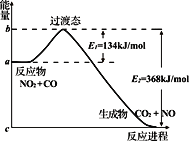
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是吸热反应又是氧化还原反应的是
A.Ba(OH)2·8H2O与NH4ClB.Al与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气D.铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 100 mL 0.1 mol·L-1 K2SO4溶液中,含有氧原子数为0.04NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C. 25 ℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
D. 100 g 17%的氨水中,含有氨分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com