
| A. | F- | B. | NH3 | C. | H2O | D. | Na+ |
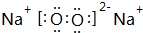
分析 不带电荷的微粒中质子数=电子数,阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数;OH-中质子数为各元素的质子数之和,一个OH-中的质子数是9个,电子数是10个.
解答 解:OH-中质子数为各元素的质子数之和,一个OH-中的质子数是9个,电子数是10个.
A、F-中质子数是9,电子数是10,和氢氧根离子中质子数和电子数都相同,故A正确;
B、NH3分子中质子数是10,电子数是10,和氢氧根离子中质子数不同,电子数相同,故B错误;
C、H2O中质子数是10,电子数是10,和氢氧根离子中质子数不同,电子数相同,故C错误;
D、Na+中质子数是11,电子数是10,和氢氧根离子中质子数不同,电子数相同,故D错误.
故选A.
点评 本题考查了质子数和电子数的计算,难度不大,明确阴阳离子中电子数和质子数的关系是解本题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
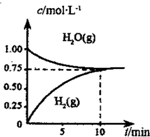 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
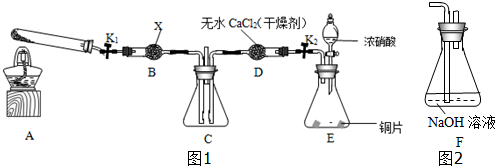
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.
A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.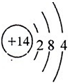
 .
. Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的
Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com