
【题目】下列实验操作或记录正确的是
A. 常温常压下测得1 mol N2的质量为28 g
B. 用量筒测得排水法收集制得的氢气的体积为50.28 mL
C. 用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D. 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)B中含有的官能团名称为___________。
(2)写出A的结构简式:_______________________________。
(3)①、④的反应类型分别为__________反应、__________反应。
(4)写出反应②和④的化学方程式:
②________________________________________________________________;
④________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
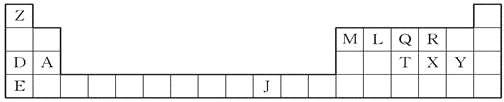
(1)T、X、Y原子的第一电离能由小到大的顺序是____________(用元素符号表示)。
(2)LX2分子的电子式是________________,XY2分子是____________(填“极性分子”或“非极性分子”);QY3分子中Q采用________杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是___________________________;写出与配位体微粒互为等电子体的离子、分子各一种________、________。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有_________种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式__________________。
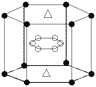
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高纪录。右图所示的是该化合物的晶体结构单元。图中上下底面中心“△”处的原子是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
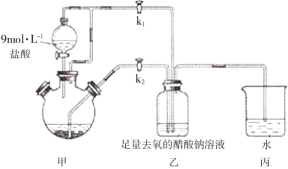
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量。
(1)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_________。
(2) 实现步骤③中溶液自动转移至装置乙中的实验操作为_________。
(3) 装置丙中导管口水封的目的是__________________。
(4) 为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是_____ 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.4g,则该实验所得产品的产率为_________(不考虑溶解的醋酸亚铬水合物,Mr[Cr(CH3COO)2]2·2H2O =376g/mol)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为_________才能使铬的离子沉淀完全。
【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
(7) 一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是
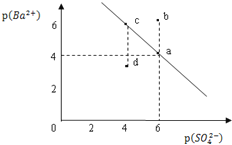
A. 该温度下,Ksp(BaSO4)=1.0×10-24
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)铜是一种重要的有色金属,近年来用途越来越广泛。请回答下列问题:
(1)下列四种化合物中含铜量最高的是______(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为________万吨。(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物。在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O)。
①该制备过程的反应方程式为____________________________________________。
②工业上常用的固液分离设备有________(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀。右图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是____(填“a”“b”或“c”),正极反应方程式为_______________。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为:___________(用离子方程式表示)。
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________。
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-=2SO42-+I2 ① I2+2S2O32-=2I-+S4O62- ②
S2O82-、S4O62-、I2氧化性强弱顺序_______。
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
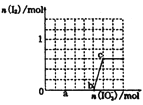
①a点处的还原产物是:________(填离子符号);
b点→c点反应的离子方程式是________。
②当溶液中的I-为0.5mol时、加入的KIO3可能是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)下图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物。其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一。B常温下为液态化合物,F是一种直线型的非极性气体分子。
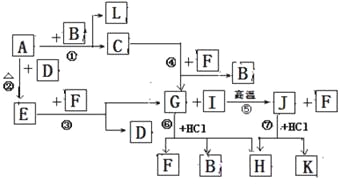
试回答下列有关问题:
(1)以上7个化学反应属于同种元素自身氧化还原反应的是 ;(用编号①→⑦填写)
(2)在G、J、H中含有相同的元素是 (填元素名称);
(3)J的水溶液和F______(填“能”或”否”)发生反应,其理由是 ;
(4)写出电解溶液H的离子反应方程式 ;
(5)反应⑤的化学方程式是 ;
(6)写出J的两种常见用途 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com