
| A. | Ne和Na+的结构示意图均为 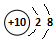 | B. | 聚氯乙烯的结构简式为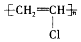 | ||
| C. | 二氧化碳分子的比例模型: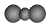 | D. | NH4Br的电子式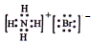 |
分析 A.钠离子核内11个质子;
B.聚氯乙烯不含碳碳双键;
C.氧原子半径小于碳原子半径;
D.溴化铵为离子化合物,氨根离子与溴离子通过离子键结合.
解答 解:A.钠离子核内11个质子,结构示意图: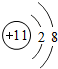 ,故A错误;
,故A错误;
B.聚氯乙烯不含有碳碳双键,结构简式为: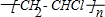 ,故B错误;
,故B错误;
C.二氧化碳分子中碳原子半径大于氧原子,二氧化碳正确的比例模型为: ,故C错误;
,故C错误;
D.溴化铵为离子化合物,氨根离子与溴离子通过离子键结合,电子式为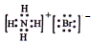 ,故D正确;
,故D正确;
故选:D.
点评 本题考查了常见化学用语的书写判断,题目难度中等,注意掌握比例模型、离子结构示意图、结构式、电子式等化学用语的概念及书写原则,明确原子结构示意图与离子结构示意图、比例模型与球棍模型、最简式与分子式的关系.


科目:高中化学 来源: 题型:选择题
| A. | 向铝盐溶液中不断加入小苏打 | B. | 向偏铝酸钠溶液中不断滴加盐酸 | ||
| C. | 向烧碱溶液中不断滴入铝盐溶液 | D. | 向铝盐溶液中不断滴入烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
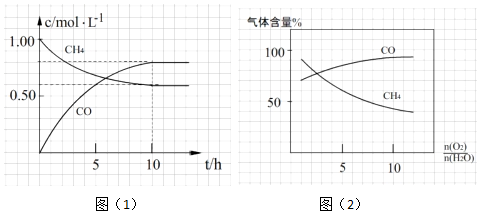
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
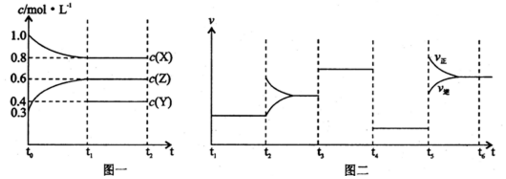
| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 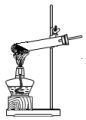 制备NH3 | B. | 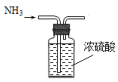 干燥NH3 | C. | 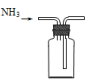 收集NH3 | D. | 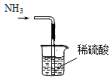 吸收多余NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
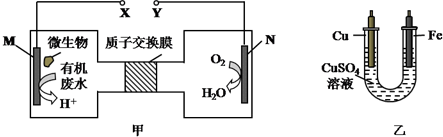
| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com