
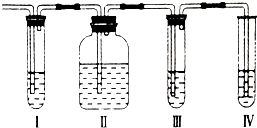
 在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:| 光照 |


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
A、H2(g)+
| ||
B、H2O(g)=H2(g)+
| ||
| C、2H2(g)+O2(g)=2H2O(l);△H=-484kJ?mol-1 | ||
| D、2H2(g)+O2(g)=2H2O(g);△H=+484kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阳极 |
| C、放电时溶液中的OH-移向正极 |
| D、放电时负极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g甲醇中含有C-H键的数目为4NA |
| B、1L 0.1mol?L-1的氨水含有0.1NA个OH- |
| C、10L pH=1的硫酸溶液中含有的H+数为2NA |
| D、H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.如图为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/L CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/L CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com