
分析 先根据影响水的电离平衡的因素分析,酸和碱抑制水的电离,能水解的盐促进水的电离,水溶液中一定温度下存在氢氧根离子浓度和氢离子浓度乘积是常数,存在水的离子积,可以计算溶液中水电离出的氢离子进行比较.
解答 解:①pH=0的盐酸[H+]酸=1mol/L,抑制水的电离,水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,由水溶液中的离子积计算:[H+]酸[OH-]水=10-14,[OH-]水=[H+]水=10-14mol•L-1;
②0.5mol•L-1盐酸溶液中[H+]酸=0.5mol/L,抑制水的电离,所以根据水溶液中的离子积计算:[H+]酸[OH-]水=10-14,[OH-]水=[H+]水=2×10-14mol•L-1;
③0.1mol•L-1的NH4Cl溶液(pH约为5),溶液中氢离子全部由水电离,则[H+]水=10-5mol•L-1;
④0.1mol•L-1的NaOH溶液中[OH-]碱=0.1mol/L,根据水溶液中的离子积计算:[H+]水[OH-]碱=10-14,[OH-]水=[H+]水=10-13mol•L-1;
⑤0.5mol•L-1的NH4Cl溶液,NH4++H2O?NH3•H2O+H+;溶液的pH比0.1mol•L-1的NH4Cl溶液的pH小,则水电离出的氢离子浓度大,即[H+]水大于10-5mol•L-1;
⑥1mol•L-1的NaCl溶液显中性,[H+]水=10-7mol•L-1;
综上所述:溶液中水电离的c(H+)由大到小的顺序是⑤③⑥④②①,
故答案为:⑤③⑥④②①;10-14mol•L-1;10-5mol•L-1.
点评 本题考查了水的电离平衡的影响因素,水溶液中离子积的应用,主要是水解的盐对水的电离的影响判断,③⑤的比较是关键,题目难度不大,侧重于考查学生的分析能力和计算能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
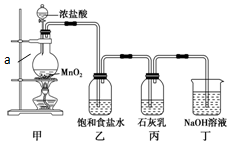 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol H2O在标准状况下的体积为22.4 L | |
| D. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
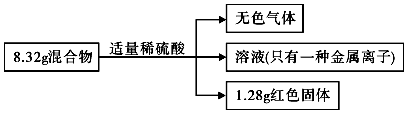
| A. | 无色气体的体积为2.24L | |
| B. | 原混合物中铁的质量为6.72g | |
| C. | 反应后的溶液中金属离子物质的量为0.02 mol | |
| D. | 反应消耗的H2SO4物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和AlCl3 | B. | 稀盐酸和NaOH | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
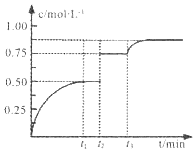 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质C | |
| D. | t1~t3间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| C. | 氯水中放入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| D. | 1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com