
| A. | 容器内只含有18O2、SO2、SO3三种分子 | |
| B. | 18O只存在18O2分子中 | |
| C. | 容器内含有18O2、S18O2、S18O3等分子 | |
| D. | 反应达到限度时,容器内只含有18O2、S18O2、S18O3分子 |
分析 该反应为可逆反应,SO2和O2反应生成SO3的同时,SO3分解生成SO2和O2,可逆反应不会进行彻底.
解答 解:该反应为可逆反应,在混合气体中充入一定量的18O2,SO2和18O2反应生成SO3中含有18O,同时SO3分解生成SO2和O2,则SO2中含有18O原子,则18O原子存在于O2、SO2和SO3中,根据可逆反应不会进行彻底,2mol SO2和1mol18O2在一定条件下,不会全部转化为三氧化硫,即生成三氧化硫的量小于2mol,
A.18O原子存在于O2、SO2和SO3中,故A错误;
B.SO2和18O2反应生成SO3中含有18O,同时SO3分解生成SO2和O2,18O原子存在于O2、SO2和SO3中,故B错误;
C.在混合气体中充入一定量的18O2,SO2和18O2反应生成SO3中含有18O,同时SO3分解生成SO2和O2,则SO2中含有18O原子,则18O原子存在于O2、SO2和SO3中,容器内含有18O2、S18O2、S18O3等分子,故C正确;
D.反应达到限度时,达到平衡状态,容器内含有18O2、S18O2、S18O3分子,还可能含有SO2、SO3分子,故D错误;
故选C.
点评 本题考查化学反应的可逆性,题目难度不大,注意可逆反应的特点,同位素原子在反应中的存在形式,此类题目易出错.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
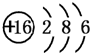 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 陈述Ⅰ | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对,有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.5mol•L-1,Y2为1.0mol•L-1 | B. | Y2为1.0mol•L-1 | ||
| C. | X2为0.5mol•L-1,Z为0.2mol•L-1 | D. | Z为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
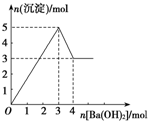 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO4 | B. | KAl(SO4)2 | C. | Al2(SO4)3 | D. | Na AlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com