
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
【答案】
(1)Ne
(2)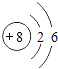
(3)C
(4)HF
(5)N
(6)Al
(7)NaOH; HClO4
(8)SO2;1:1
【解析】解:(1)稀有气体的化学性质最不活泼,Ne为稀有气体,故答案为:Ne;(2)O原子含有8个质子、8个核外电子,核外电子排布为:K层2个电子、L层6个电子,O的原子结构示意图为: 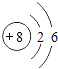 ,
,
故答案为: 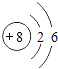 ;(3)有机物种类繁多,C是构成有机化合物的重要元素,因此形成化合物种类最多的元素是C,
;(3)有机物种类繁多,C是构成有机化合物的重要元素,因此形成化合物种类最多的元素是C,
故答案为:C;(4)非金属性:F>O,因此热稳定性:HF>H2O,因此HF和H2O中,热稳定性较强的是HF,
故答案为:HF;(5)同主族自上而下原子半径逐渐增大,N和P处于第ⅤA族,因此原子半径:P>N,
故答案为:N;(6)常温下,铝和铁会在浓硫酸中发生钝化,因此常温下,会在浓硫酸中发生钝化的金属是铝,
故答案为:Al;(7)元素的金属性越强,其最高价氧化物对应水化物的碱性越强,在题目所给元素中Na的金属性最强,因此元素最高价氧化物对应水化物中,碱性最强的是NaOH,
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强(F、O除外),除去F、O,Cl的非金属性最强,因此酸性最强的是HClO4,
故答案为:HClO4;(8)二氧化硫可以漂白品红溶液,二氧化硫的化学式为SO2,硫元素和氧元素的质量比m(S):m(O)=32:16×2=1:1,
故答案为:SO2;1:1.
(1)稀有气体的化学性质最不活泼;(2)O原子含有8个质子、8个核外电子,核外电子排布为:K层2个电子、L层6个电子;(3)C是构成有机化合物的重要元素;(4)非金属性:F>O,因此热稳定性:HF>H2O;(5)同主族自上而下原子半径逐渐增大;(6)常温下,铝和铁会在浓硫酸中发生钝化;(7)元素的金属性越强,其最高价氧化物对应水化物的碱性越强,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强(F、O除外);(8)二氧化硫可以漂白品红溶液.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4x B. 4x+6 C. 4x+10 D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
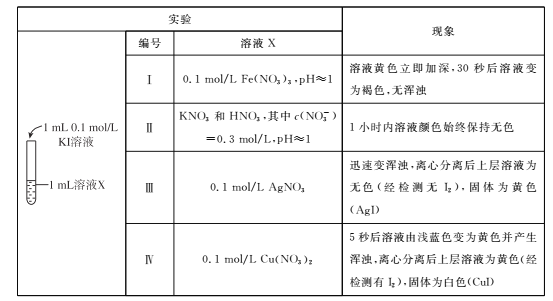
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。

K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个![]() ,1个
,1个![]() 。下列关于
。下列关于![]() 和
和![]() 的说法不正确的是
的说法不正确的是
A. 是元素X的两种不同核素 B. 电子数相差1
C. 中子数分别为176和177 D. 它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题
(1)铵态氮肥不稳定,受热易分解.写出氯化铵(NH4Cl)受热发生分解反应的化学方程式 .
(2)乙烯能使溴水褪色,生成1,2﹣二溴乙烷(CH2 Br﹣CH2 Br).写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组设计如下图装置制取SO2,研究其性质,并进一步探究不同浓度硫酸的氧化性

请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式________________。
(2)实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。
请简述理由:______________________________________________。
(3)E装置的作用为_____________________________。
Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。
(4)溶液X中一定大量含有的金属阳离子是___________,简述如何检验溶液X中该离子______________________。
(5)为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
___________(填仪器名称)中;滴定终点的现象为______________________________。
②气体Y中SO2的物质的量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标准状况下,气体摩尔体积约为22.4L/mol。则在常温常压下(25℃,101kPa)0.2mol气体A的体积为 ( )
A.4.48LB.大于4.48LC.小于4.48LD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下面每一小题:
(1)下列各物质中,互为同位素的是__________,互为同素异形体的是______,互为同系物的是_______,互为同分异构体的是________。
①金刚石与石墨 ②12C与l4C ③乙酸和甲酸甲酯 ④ 与
与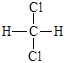
⑤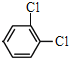 与
与![]() ⑥
⑥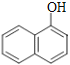 与
与![]()
⑦CH3-CH3和
(2)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为______。
(3)写出在光照条件下,甲烷与氯气发生反应生成气态有机物的化学方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com