
| A. | 混合物:草木灰、漂白粉、水玻璃、水银 | |
| B. | 化合物:纯碱、烧碱、小苏打、食醋 | |
| C. | 电解质:明矾、石膏、冰醋酸、硫酸钡 | |
| D. | 同素异形体:金刚石、石墨、C60、CO |
分析 A.化合物是不同元素组成的纯净物,水银是单质;
B.不同物质组成的物质是化合物;
C.电解质是水溶液中或熔融状态下导电的化合物;
D.同种元素组成的不同单质为同素异形体;
解答 解:A.草木灰主要成分为碳酸钾、漂白粉为氯化钙和次氯酸钙的混合物、水玻璃是硅酸钠的水溶液属于混合物,但水银是单质,故A错误;
B.:纯碱为碳酸钠、烧碱为氢氧化钠、小苏打为碳酸氢钠,都是一种物质组成的纯净物,食醋是醋酸溶液为混合物,故B错误;
C.明矾、石膏、冰醋酸在水溶液中可以发生电离,属于电解质,硫酸钡在熔融态时发生电离,属于电解质,故C正确;
D.金刚石、石墨、C60、都是一种元素组成的碳元素的不同单质为同素异形体,CO是不同元素组成的化合物,故D错误;
故选C.
点评 本题考查了化学基本概念的理解和应用,题目难度不大,熟悉混合物、化合物、单质、化合物、电解质、非电解质、同素异形体等概念的分析即可判断,掌握物质的组成是解题关键.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中 | |
| B. | 定容时,若仰视,则所配溶液的浓度将偏高 | |
| C. | 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分 | |
| D. | 在使用容避瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸雕刻玻璃:Si+4HF═SiF4↑+2H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
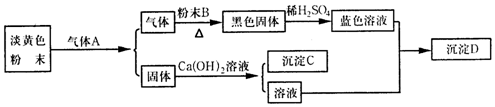
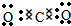 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入乙醇的目的是降低溶剂的极性,促使[Cu(NH3)4]SO4晶体析出 | |
| B. | 该配合物晶体中,N是配位原子,NH3为三角锥形,配位数是4 | |
| C. | 配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化 | |
| D. | 向该晶体的水溶液中加入浓BaCl2溶液无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 12 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
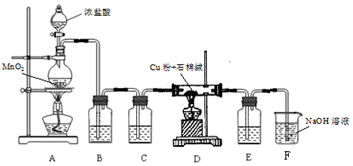
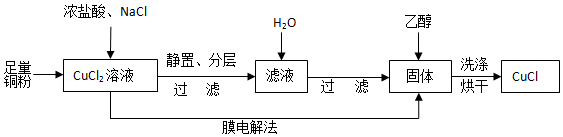
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
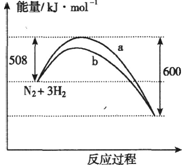
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为69kJ,则N2的转化率为75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com