
| ||
| A、该反应中氧化剂与还原剂物质的量之比为3:1 |
| B、AlN是还原产物 |
| C、AlN的摩尔质量为41g |
| D、上述反应中,每生成lmolAlN需转移6mol电子 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
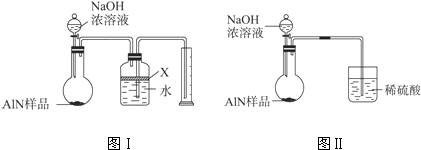
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用图Ⅰ所示的装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O====NaAlO2+NH3↑,已知NH3极易溶解于水,Al在常温下能与NaOH溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
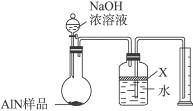
图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷 B.酒精 C.植物油 D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。
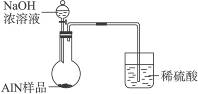
图Ⅱ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com