
【题目】在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:

(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________(填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________
【答案】H2 紫色向D处移动 变大 O2+4e- +2H2O=4OH-
【解析】
A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后,倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,AB、CD处是电解原理的应用。
(1)依据A、B中气体体积变化分析,电解的是水,A端产生氧气,电解池的阳极;B端产生是氢气,为电解池的阴极,则a为电源的负极,b为电源正极;
(2)C、D为夹在滤纸两端的铂夹,与电源也构成了电解池,C与电源负极相连,为阴极,D与电源正极相连,为阳极,据此解答;
(3)断开K1,闭合K2、K3,通直流电,发生的电解反应,电解KOH溶液实质上是电解水,根据溶液中OH-的浓度与溶液的pH关系分析判断;
(4)若电解一段时间,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,A、B中形成的氢氧燃料电池,依据原电池原理分析判断。
(1)切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得H2,A极上得到O2,所以B极是阴极,A极是阳极,则a是负极,b是正极;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子K+向阴极C电极区域移动,阴离子MnO4-向阳极D区域移动,所以D极附近的溶液呈紫色;
(3)切断K1,合闭K2、K3,电解较长一段时间,A、B中均有气体包围电极,电解KOH溶液,实质上是电解H2O,H2O不断电解消耗,使得KOH的浓度逐渐增大,则溶液中c(OH-)增大,因此一段时间后溶液的pH会变大;
(4)若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,闭合K1,构成氢氧燃料电池,在燃料电池中,燃料氢气所在的B电极为负极,失去电子,发生氧化反应,电极反应式为2H2+4OH--4e-=4H2O;氧气所在的A电极为正极,O2获得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是

A. 图1为证明非金属性强弱:S > C > Si
B. 图2为制备少量氧气
C. 图3为配制一定物质的量浓度的硫酸溶液
D. 图4为制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在热的稀![]() 中反应,其主要还原产物为
中反应,其主要还原产物为![]() ,而在冷的稀
,而在冷的稀![]() 中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为
中反应,其主要还原产物为NO,当溶液更稀时,其还原产物为![]() 。请分析如图,回答有关问题。
。请分析如图,回答有关问题。

![]() 假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时的化学反应方程式:_____Fe+____HNO3—____Fe(NO3)3+_________+____H2O
![]() 判断从o点到a点时的还原产物,应是___________
判断从o点到a点时的还原产物,应是___________
![]() 点到b点时产生还原产物为_________,其原因是______________
点到b点时产生还原产物为_________,其原因是______________
![]() 已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
已知达到d点时反应完全结束,此时溶液中的主要阳离子为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
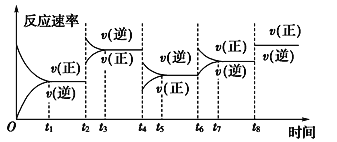
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
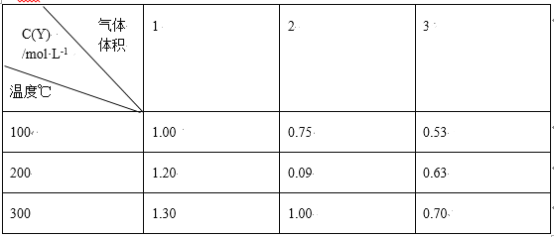
下列说法正确的是
A.m>nB.Q<0
C.温度不变,压强增大,Y的质量分数减少D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,该反应的平衡常数K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)=_______________,CO的转化率α(CO)=___________。
(4)将合成气以![]() =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃时,起始时![]() =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中![]() 约为___________时最有利于二甲醚的合成。
约为___________时最有利于二甲醚的合成。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏加德罗常数的数值,下列叙述正确的是
A.1molL-1 MgCl2溶液中的Mg2+数为NA
B.1 mol Na2O2固体中含阴离子总数为2NA
C.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA
D.100 mL 12molL-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用0.2000mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O42H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0g草酸晶体,配成250.00mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00mL放入锥形瓶中,用0.2000mol/L的酸性KMnO4溶液滴定.
①量取25.00mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
![]()
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com