

分析 (1)根据化学反应速率v=$\frac{△c}{△t}$来计算;
(2)平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$来书写;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)改变温度、浓度、压强等因素可以引起化学平衡的移动,根据化学平衡移动原理来回答.
解答 解:(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=$\frac{△c}{△t}$=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),故答案为:0.075mol/(L•min);
(2)该反应的平衡常数表达式K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2}){•c}^{3}({H}_{2})}$;故答案为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2}){•c}^{3}({H}_{2})}$;
(3)a.反应前后气体系数和不等,当容器中压强不变的状态是平衡状态,故正确;
b.v正(H2)=v逆(H2O)不能说明正逆反应速率相等,此时不一定平衡,故错误;
c.混合气体c(H2O)不变是平衡状态的特征,故正确;
d.c(CO2)=c(CH3OH),不能说明正逆反应速率相等,此时不一定平衡,故错误.
故选ac.
(4)a、升高温度,平衡正向移动,故a正确;
b.将CH3OH(g)及时液化抽出,平衡正向移动,故b正确;
c.选择高效催化剂不会改变化学平衡,只能改变反应速率,故c错误;
d.再充入H2O(g)平衡逆向移动,故d错误;
故选ab.
点评 本题考查化学平衡图象、影响化学平衡的因素以及反应速率的计算等,难度中等,注意知识的灵活应用是关键.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
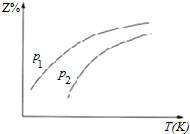
| A. | △H<0 | |
| B. | 若p1>p2,则Y一定呈气态 | |
| C. | 升高温度,该反应的化学平衡常数减小 | |
| D. | 反应处于平衡状态时,有c(X):c(2)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
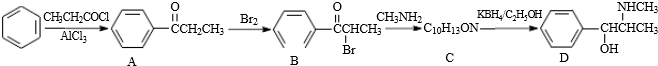
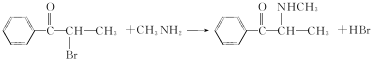 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.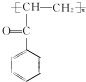
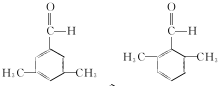 (写结构简式).
(写结构简式). 参照上述合成路线,设计一条由苯和乙酸为起始原料制备
参照上述合成路线,设计一条由苯和乙酸为起始原料制备 的合成路线:
的合成路线: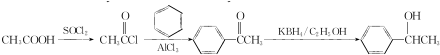 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| B. | 25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3•H2O的电离常数为$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①=③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量15%的Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com