
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为________、________;
(2)XZ2与YZ2分子的空间构型分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是____________________________________
________________________________________________________________________
________________________________________________________________________;
(3)Q的元素符号是________,它属于第________周期,它的核外电子排布式为________,在形成化合物时它的最高化合价为________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
离子方程式书写
(1)[2014·新课标全国卷Ⅰ,27(1)]H3PO2是一元中强酸,写出其电离方程式________________________________________________________________________。
(2)[2014·大纲全国卷,27(1)节选]已知非金属元素A最外层电子数与其周期数相同,且A在F中燃烧,产物溶于水得到一种强酸(注:A、F均为短周期元素)。写出一种工业制备单质F的离子方程式
________________________________________________________________________。
(3)[2014·天津理综,9(4)改编]已知Na2S2O3在中性或碱性条件下稳定,在酸性条件下会变黄,用离子方程式表示变黄的原因:________________________________________________________________________。
(4)[2014·山东理综,30(3)节选]取少量铝粉和Fe2O3做铝热反应后所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是________________________________________________________________________
(用离子方程式说明)。
(5)[2014·四川理综,8(4)改编]将铜单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。
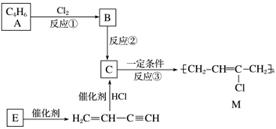
已知:H2CCHCCH由E二聚得到
完成下列填空:
(1)A的名称是________________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式_________________________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式:_____________________________________________________________________。
鉴别这两个环状化合物的试剂为_____________________________________________。
(4)以下是由A制备工程塑料PB的原料之一1,4丁二醇(BDO)的合成路线:

写出上述由A制备BDO的化学反应方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键形成的非极性分子。根据上述事实可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子
B.在ABn分子中A原子的所有价电子都参与成键
C.在ABn分子中每个共价键都相同
D.在ABn分子中A的相对原子质量应小于B的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.分子的结构是由键长决定的
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D.H2O分子中2个O—H键夹角为180°
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
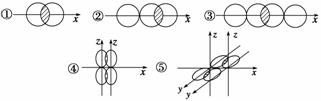
| ① | ② | ③ | ④ | ⑤ | |
| 化学键类型 | |||||
| 举例 |
(2)某有机物的结构式如下:

则分子中有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是( )
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
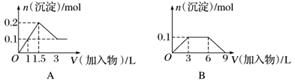
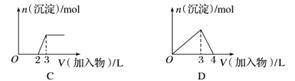
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com