
| A. | $\frac{a}{36V}$mol/L | B. | $\frac{a}{18V}$mol/L | C. | $\frac{a}{54V}$mol/L | D. | $\frac{a}{27V}$mol/L |
分析 根据n=$\frac{m}{M}$计算出ag铝离子的物质的量,再根据硫酸铝的化学式计算出硫酸根离子的物质的量,从而可知取出的$\frac{V}{2}L$溶液中含有硫酸根离子的物质的量,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中硫酸根离子的浓度.
解答 解:VL Al2(SO4)3溶液中含agAl3+,含有铝离子的物质的量为:$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
根据化学式Al2(SO4)3可知,VL该溶液中含有硫酸根离子的物质的量为:$\frac{a}{27}$mol×$\frac{3}{2}$=$\frac{a}{18}$mol,
从中取出$\frac{V}{2}L$,取出的溶液中含有硫酸根离子的物质的量为:$\frac{a}{18}$mol×$\frac{1}{2}$=$\frac{a}{36}$mol,
稀释过程中硫酸根离子的物质的量不变,则稀释后SO42-的物质的量浓度为:$\frac{\frac{a}{36}mol}{VL}$=$\frac{a}{36}$mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 6.02×1023 | C. | 0.25mol | D. | 0.25g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
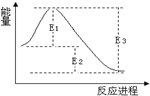
| A. | 该反应常温下一定可以自发进行 | |
| B. | 使用催化剂可以改变E1、E2、E3的大小,从而改变正逆反应速率 | |
| C. | E2为该反应的焓变,且该反应的△H<0 | |
| D. | 该反应反应物能量大于生成物能量,故可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 浓硫酸不慎滴到皮肤上,先用较多的水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| D. | 除去粗盐中的硫酸盐应加入BaCl2溶液,离子反应为Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-6 |
| H2B | 4.2×10-7 | 5.6×10-7 |
| A. | H2A的电离方程式:H2A═2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Ka1=$\frac{K_W}{{4.2×{{10}^{-7}}}}$ | |
| C. | 等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者 | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
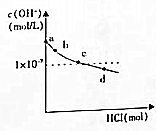
| 坐标对应点 | a | b | c | d |
| n(SO32-)n:(HSO3-) | 91:9 | 1:1 | 9:91 | |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com