

| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |
分析 A.互不相溶的液体采用分液方法分离;
B.浓硫酸和乙醇混合加热需要170℃,温度计测量溶液温度;
C.互溶的液体采用蒸馏方法分离,蒸馏时温度计水银球位于烧瓶支管口处;
D.乙醇也能被酸性高锰酸钾溶液氧化.
解答 解:A.互不相溶的液体采用分液方法分离,水和溴苯不互溶,所以可以采用分液方法分离,故A正确;
B.浓硫酸和乙醇混合加热需要170℃,温度计测量溶液温度,温度计应该插入混合溶液中,故B错误;
C.互溶的液体采用蒸馏方法分离,蒸馏时温度计水银球位于烧瓶支管口处,且苯易挥发,所以应该采用水浴加热,故C正确;
D.乙醇易挥发,所以生成的乙烯中含有乙醇,乙醇也能被酸性高锰酸钾溶液氧化,应该先除去乙醇,然后用酸性高锰酸钾溶液检验乙烯,故D错误;
故选AC.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、物质的分离和提纯、物质的制备等知识点,明确实验原理是解本题关键,会从实验操作规范、实验原理等方面判断,易错选项是D.


科目:高中化学 来源: 题型:解答题
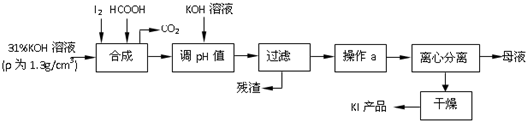
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三电子层上有4个电子 | B. | 最高正价为+2 | ||
| C. | 最高正价为+4 | D. | 第二电子层没有未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图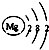 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
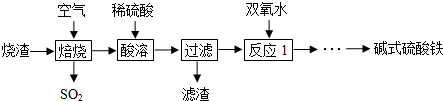
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | X是活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是最活泼的非金属元素,不存在最高价氧化物的水化物 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | X、Y、Z的单质中Z的熔点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com