
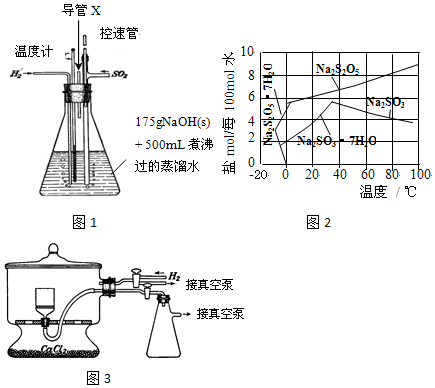
分析 (1)铝和NaOH溶液反应生成偏铝酸钠和氢气;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高;温度小于100℃时要采用水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小;控制“30℃左右”时,此时溶液中Na2SO3不饱和;
(5)焦亚硫酸钠能被压强氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
解答 解:(1)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)该装置中二氧化硫和氢氧化钠发生反应,通入氢气能防止亚硫酸盐被氧化,如果锥形瓶内压强过大会产生安全事故,所以导管的作用是排出H2、未反应的SO2及水蒸气等,从而防止安全事故的发生,
故答案为:排出H2、未反应的SO2及水蒸气等;
(3)SO2与NaOH溶液的反应是放热反应导致溶液温度升高,所以溶液“温度迅速升高”;温度小于100℃时要采用水浴加热,需要的温度是80℃,所以用水浴加热;
故答案为:SO2与NaOH溶液的反应是放热反应;80℃水浴加热;
(4)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小,所以要趁热过滤;控制“30℃左右”时,此时溶液中Na2SO3不饱和,不析出,
故答案为:趁热过滤;此时溶液中Na2SO3不饱和,不析出;
(5)焦亚硫酸钠能被压强氧化,则通入氢气的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化,从而减少产品氧化,
故答案为:排出空气,防止焦亚硫酸钠被氧化;干燥室内部的压力低,水分在低温下就能气化,减少产品氧化;
(6)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点,需要的操作是加入1~2mL淀粉溶液,
故答案为:加入1~2mL淀粉溶液;
⑤继续做实验为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积,然后再重复实验,减少实验误差,
故答案为:继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生实验操作、实验评价、物质制备能力,知道各个仪器的作用,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
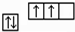 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com