
 某原电池装置如图所示.下列有关叙述正确的是( )
某原电池装置如图所示.下列有关叙述正确的是( )| A、Cu为正极,发生氧化反应 |
| B、负极反应式为:2H++2e-=H2↑ |
| C、工作一段时间后,烧杯中溶液pH不变 |
| D、电池工作时,SO42-向Zn电极移动 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
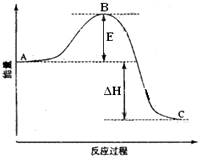 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol?L |
| B、1mol Zn与足量的该硫酸反应产生2g氢气 |
| C、配制200mL 4.6mol?L的稀硫酸需取该硫酸50mL |
| D、50mL该硫酸溶液中加入足量的铜片并加热,充分反应后被还原的硫酸的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
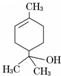
| A、分子式为C10H16O |
| B、能使酸性高锰酸钾溶液褪色 |
| C、分子中含有两种官能团 |
| D、能够与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、X、Y、Z的原子半径大小顺序可能是:W>X>Y>Z |
| B、WY2分子中δ键与π键的数目之比是1:1 |
| C、Y、Z形成的分子空间构型可能是直线形 |
| D、W、Y、Z的电负性大小顺序一定是Z>Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多 |
| B、氯化钠溶液呈中性,醋酸钠溶液呈碱性 |
| C、相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
| D、等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有漂白性,可用于漂白纸浆 |
| B、FeCl3溶液能将Cu氧化,可用于制作印刷电路板 |
| C、难溶的Al2O3制成的坩埚,可用于熔融烧碱 |
| D、处理锅炉水垢中的CaSO4,可先用饱和NaCO3溶液浸泡,后加盐酸除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com