


科目:高中化学 来源: 题型:
查看答案和解析>>
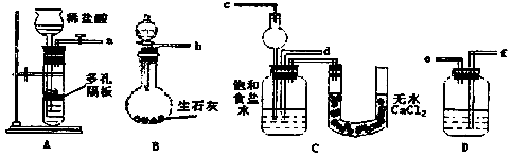
科目:高中化学 来源: 题型:
查看答案和解析>>
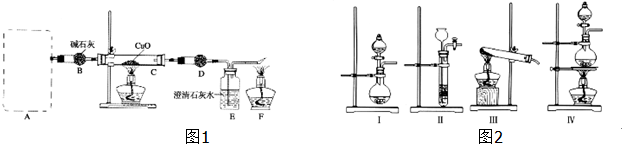
科目:高中化学 来源: 题型:
 恒容体系,发生如下反应2A(g)?B(g)+xC(g)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图.某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度).
恒容体系,发生如下反应2A(g)?B(g)+xC(g)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图.某课外活动小组一共进行了如图所示的三个实验(其中T1、T2表示不同的反应温度).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持温度和容器压强不变,充入1mol SO3 (g) |
| B、保持温度和容器压强不变,充入1mol SO2 (g) |
| C、保持温度和容器体积不变,充入1mol SO3 (g) |
| D、保持温度和容器体积不变,充入1mol Ar (g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属腐蚀的实质就是金属原子失去电子被还原的过程 |
| B、为了使原电池能持续稳定的产生电流需使用盐桥,盐桥中的阳离子应向负极迁移 |
| C、牺牲阳极的阴极保护法和外加电源的阴极保护法利用的都是电解原理 |
| D、铅蓄电池充电时溶液的pH值逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com