
| A. | 2H2(g)+O2(g)=2H2O(g);△H12H2(g)+O2(g)=2H2O(l);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1S(s)+O2(g)=SO2(g);△H2 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H12CO(g)+O2(g)=2CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、化学反应方程式的系数加倍,焓变数值加倍;
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B正确;
C、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,反应的焓变是负值,故2△H1=△H2,△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,故△H1=2△H2,△H1<△H2,故D正确;
故选BD.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,2v (H2) 正=3v (NH3) 逆 | |
| D. | 加入催化剂,正反应速率增大,逆反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述参加反应的NH3和生成H2的体积之比为3:2 | |
| B. | 同温同压下,NH3、H2的密度之比为2:17 | |
| C. | 相同质量的NH3、H2分子数之比为17:2 | |
| D. | 同温同体积下,相同质量NH3、H2的压强之比为2:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分散系的分类 | |
| B. | 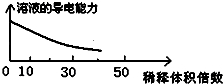 醋酸稀释 | |
| C. | 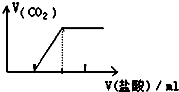 向Na2CO3溶液中逐滴滴入盐酸 | |
| D. | 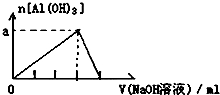 向AlCl3溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为-283 kJ•mol-1 | |
| B. | CO的燃烧热为566 kJ•mol-1 | |
| C. | CO的燃烧热△H=-283 kJ•mol-1 | |
| D. | 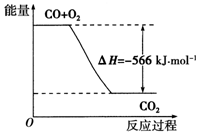 如图可表示由CO生成CO2的反应过程和能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖,冒出大量气泡 | |
| B. | 实验室常用排饱和食盐水法收集Cl2 | |
| C. | 平衡体系2NO2?N2O4△H<0,升高温度,颜色变深 | |
| D. | 平衡体系H2(g)+I2(g)?2HI(g),缩小体积,颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com