
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
分析 A.聚乙烯中不含碳碳双键;
B.苯与溴水不反应;
C.烷烃中C原子越多,沸点越大;
D.丙烯中含碳碳双键,与溴发生加成反应.
解答 解:A.聚乙烯中不含碳碳双键,则不能使溴的四氯化碳溶液褪色,而油脂可以,故A错误;
B.苯与溴水不反应,应选苯、液溴、铁粉混合制成溴苯,故B错误;
C.烷烃中C原子越多,沸点越大,则沸点:戊烷>丁烷>乙烷,故C正确;
D.丙烯中含碳碳双键,与溴发生加成反应,则由丙烯加溴制1,2-二溴丙烷,故D正确;
故选CD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物的组成及官能团,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第IA的元素全部是金属元素 | |
| B. | 元素周期表有18个族 | |
| C. | 元素周期表含元素最多的族是第ⅢB族 | |
| D. | 短周期是指第一、二、三、四周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力 | B. | 氢键 | C. | 非极性共价键 | D. | 极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,最有潜力的应用是成为硅的替代品用来生产未来的超级计算机 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 为迎接G20峰会,全温州市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 932kJ | B. | 859 kJ | C. | 538 kJ | D. | 496kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
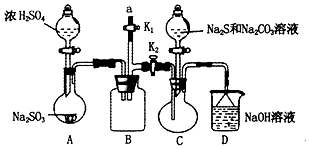 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )
《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )| A. | 盛装电石的包装上贴有的危险化学品标志为: | |
| B. | 电石与硝酸分开存放 | |
| C. | 运输电石的铁桶内可充入氮气 | |
| D. | 电石着火可用泡沫灭火器扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com