
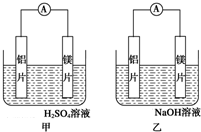
 �мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6mol•L-1��H2SO4��Һ�У���ͬѧ���缫����6mol•L-1��NaOH��Һ�У���ͼ��ʾ��
�мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6mol•L-1��H2SO4��Һ�У���ͬѧ���缫����6mol•L-1��NaOH��Һ�У���ͼ��ʾ������ ��ͬѧ���ݵĻ�ѧ��Ӧԭ����Mg+H2SO4=MgSO4+H2������ͬѧ���ݵĻ�ѧ��Ӧԭ����2Al+2NaOH+2H2O 2NaAlO2+3H2��������Al�����ԣ������ܷ�����Ӧ����1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��
2NaAlO2+3H2��������Al�����ԣ������ܷ�����Ӧ����1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��
��2���ҳ�������ʧ������������þ����������������ʧ���ӷ���������Ӧ��
��3�������������Ľ���������ǿ��ϵ���еĸ����жϣ�
��4��A��ԭ�����������������Һ�йأ�
B��þ�Ľ����Դ�������
C����ʵ��֤��˵���������Һ����ѡ��ѡ����ʵĽ��ʣ�����˵���������˳���ʱ��
D����ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ����������������
��5������ͨ��������ķ������ж�ԭ��ص���������
��6���������ķ�ӦΪ��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����MgSO4+2NaOH=Mg��OH��2��+Na2SO4��Al2��SO4��3+6NaOH=2Al��OH��3��+3Na2SO4�����ݷ�Ӧ�ķ���ʽ���㣮
��� �⣺��1������þ��ʧ������������Al��������������þ����������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪMg-2e-=Mg2+��������ӦΪ2H++2e-=H2����
�ʴ�Ϊ��2H++2e-=H2����
��2���ҳ�������ʧ��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Al+4OH--3e-=AlO2-+2H2O��þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al+2OH-+2H2O=AlO2-+3H2����
�ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����
��3������þ���������������������������������Ľ���������ǿ�жϣ�����þ���ǿ�����������ǿ��
�ʴ�Ϊ��Mg��Al��
��4��A�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ���A��ȷ��
B��þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ���B����
C����ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ����C����
D����ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ������������������D��ȷ��
�ʴ�Ϊ��AD��
��5������ʵ��˵������ֱ�����ý������˳����жϵ���е����������������ɿ�������ǽ�һ�������ƣ�ͨ���۲���������ж�ԭ��ص���������
�ʴ�Ϊ�����ɿ����������������õ��ߴ����������ϣ�ͨ����������ָ��ƫת�жϵ���������������������
��6���������ķ�ӦΪ��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����MgSO4+2NaOH=Mg��OH��2��+Na2SO4��Al2��SO4��3+6NaOH=2Al��OH��3��+3Na2SO4��
��1��n��H2SO4��=0.06L��5mol/L=0.3mol���������е�Mg��Alǡ����ȫ����ʱ����Һ�ɷ�ΪNa2SO4��
��ʱn��NaOH��=2n��H2SO4��=2��0.3mol=0.6mol��
����V��NaOH��=$\frac{0.6mol}{10mol/L}$=0.06L=60ml��
�ʴ�Ϊ��60��
��2��������60mlNaOH��Һʱ��þ��ǡ�ó�����������n��NaOH��=0.065L��10mol/L=0.65molʱ��
NaOH������0.65mol-0.6mol=0.05mol��������Al��OH��3+NaOH=NaAlO2+2H2O��
���ܽ��n��Al��OH��3��=0.05mol��m��Al��OH��3��=0.05mol��78g/mol=3.9g��
���������е�Mg��Alǡ����ȫ����������ӦΪ3.9g+9.7g=13.6g��
�������к���xmolMg��ymolAl����24x+27y=5.1��58x+78y=13.6����֮�ã�x=0.1��y=0.1��
Mg+H2SO4=MgSO4+H2��
0.1mol 0.1mol
2Al+3H2SO4=Al2��SO4��3+3H2��
0.1mol 0.15mol
n��H2��=0.1mol+0.15mol=0.25mol��V��H2��=0.25mol��22.4L/mol=5.6L��
�ʴ�Ϊ��5.6��
���� ���⿼����̽��ԭ���ԭ���������ļ��㣬��Ŀ�Ѷ��еȣ���ȷԭ����и����缫�Ϸ����ķ�Ӧ�ǽⱾ��ؼ���ע�ⲻ�ܸ��ݽ����Ļ��ǿ���ж���������Ҫ����ʧ�������׳̶�ȷ��������Ϊ�״��㣮


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ����� | ����Ͳ������ | ����Ͳ������ | ����Ͳ������ |
| 1 | 10mL FeSO4��Һ | 10mLNH3 | ���ɰ�ɫ���������ɫ |
| 2 | 5mL1mol/L FeCl3��Һ | 1mL1mol/L KSCN��Һ | |
| 3 | 10mL1mol/LAlCl3��Һ | 1mol/L NaOH | |
| 4 | 10mL2mol/LKAl��SO4��2��Һ | 1mol/LBa��OH��2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5��1 | B�� | 4��1 | C�� | 3��2 | D�� | 1��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �˰�ˮ��pHΪ11.48 | |
| B�� | Q��Һ�У�c��NH4+����c��Cl-����c��NH3•H2O����c��OH-����c��H+�� | |
| C�� | Q��Һ�У�2c��Cl-��=c��NH3•H2O��+c��NH4+�� | |
| D�� | �μӹ����У���Һ�п��ܻ���ڣ�c��NH4+��=c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1 mol������ȫת��ɺ���ʱ�ų�17kJ���� | |
| B�� | ����Ӧ��һ�����ȷ�Ӧ | |
| C�� | ��4g����ת��ɰ���ʱ����I7k J���� | |
| D�� | ���ױȺ����ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������pH=4��NaHC2O4��Һ�У�c��H2C2O4����c��C2O42-�� | |
| B�� | ���¶Ȳ���ʱ���ڴ�ˮ�м���ǿ����Һ����Ӱ��ˮ�����ӻ����� | |
| C�� | �����£���AgCl�ı�����Һ�м���NaCl���壬�й�����������AgCl��Ksp��С | |
| D�� | 25��ʱ��Ksp��AgCl��=1.56��10-10��Ksp��Ag2CrO4��=9.0��10-12����ͬŨ�ȵ�Na2CrO4��NaCl�����Һ�еμ�AgNO3��Һ��Ag2CrO4������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com