
 汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)由表中数据可知4s时反应到达平衡,1-3s内NO浓度变化量为4.5×10-4 mol/L-1.5×10-4 mol/L=3×10-4 mol/L,该2s内平均每秒内变化量为1.5×10-4 mol/L,随反应进行,反应速率减小,该2s中前1s内NO浓度变化量应大于1.5×10-4 mol/L,则2s时NO的浓度小于4.5×10-4 mol/L-1.5×10-4 mol/L=3×10-4 mol/L,故2s时NO的浓度应介于1.5×10-4 mol/L~3×10-4 mol/L之间;
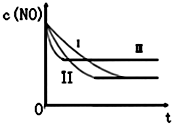
(3)由图可知,曲线Ⅰ和曲线Ⅱ相比,平衡没有移动,反应速率Ⅱ比Ⅰ快,故曲线Ⅱ中催化剂比比表面积大于Ⅰ,而其它条件相同;而曲线Ⅲ和曲线Ⅱ相比,反应速率变快且平衡逆向移动,该反应为放热反应,升高温度平衡逆向移动;
(4)①列三段表示出实验1各物质浓度的变化情况,然后根据速率公式:v(CO2)=$\frac{△c}{△t}$;
②实验组②和实验组③温度相同,平衡常数相同,根据三行式进行计算求解;
(5)①CO发生氧化反应与O2-结合生成CO32-;
②阳极上氯离子失电子,阴极上阳离子得电子.
解答 解:(1)已知:①2 NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol
②2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则依据盖斯定律,③×2-②-①得到:N2(g)+O2(g)=2NO(g) 则△H=(-393.5KJ/mol)×2-(-220KJ/mol)-(-746.5KJ/mol)=+180.5KJ/mol,
故答案为:+180.5;
(2)由表中数据可知4s时反应到达平衡,1-3s内NO浓度变化量为4.5×10-4 mol/L-1.5×10-4 mol/L=3×10-4 mol/L,该2s内平均每秒内变化量为1.5×10-4 mol/L,随反应进行,反应速率减小,该2s中前1s内NO浓度变化量应大于1.5×10-4 mol/L,则2s时NO的浓度小于4.5×10-4 mol/L-1.5×10-4 mol/L=3×10-4 mol/L,故2s时NO的浓度应介于1.5×10-4 mol/L~3×10-4 mol/L之间,选项中只有2.5×10-4 mol/L符合,
故选:D;
(3)由于②、③温度相同,催化剂对平衡移动无影响,化学平衡不移动,达到相同的平衡状态,但②的起始浓度较大,催化剂的比表面积较大,则反应的速率大,所以②先达到化学平衡;由于①、②浓度、催化剂的比面积大相同,而①的温度较高,反应速率较快,先到达平衡,且平衡向逆反应移动,平衡时NO的浓度增大,
所以曲线Ⅰ对应实验③,曲线Ⅱ对应实验②,曲线Ⅲ对应实验①,
故答案为:③;
(4)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.8mol/L 0.8mol/l 0.8mol/L 0.8mol/L
平衡0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
v(CO2)=$\frac{△c}{△t}$=$\frac{0.8mol/L}{5min}$=0.16mol/(L•min),故答案为:0.16mol/(L•min);
②H2O(g)+CO(g)?CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/L 0.2mol/L
平衡0.3mol/L 0.8mol/L 0.2mol/L 0.2mol/L
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 0.5mol/L 0 0
转化 (0.5-$\frac{c}{2}$)mol/L (0.5-$\frac{c}{2}$)mol/l $\frac{d}{2}$mol/L $\frac{d}{2}$mol/L
平衡(0.5+$\frac{c}{2}$)mol/L $\frac{c}{2}$mol/L $\frac{d}{2}$mol/L $\frac{d}{2}$mol/L
所以0.5-$\frac{c}{2}$=$\frac{d}{2}$
则:d=1-c,由平衡常数相等可知:$\frac{\frac{1-c}{2}×\frac{1-c}{2}}{(0.5+\frac{c}{2})×\frac{c}{2}}=\frac{0.2×0.2}{0.3×0.8}$,解之得c=0.6,②中H2O(g)的转化率为:$\frac{0.2}{0.5}×100%$=40%,实验组③中CO的转化率的$\frac{0.5-\frac{0.6}{2}}{0.5}$=40%,故答案为:0.6;=;
(5)①负极CO发生氧化反应与O2-结合生成CO32-,负极电极反应式为:CO+2O2--2e-=CO32-,
故答案为:CO+2O2--2e-=CO32-;
②阳极上氯离子失电子,阴极上阳离子得电子,所以电解0.1mol/L KCl溶液,其电解总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=$\frac{0.2mol}{2}$×2=0.2mol,燃料电池的负极反应方程式是CO+2O2--2e-=CO32-,消耗1molCO转移电子数=2mol,因此当转移0.2mol电子时消耗CO的物质的量为0.1mol,则CO的质量=0.1mol×28g/mol=2.8g,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;2.8.
点评 本题考查盖斯定律的应用,化学平衡常数的计算及应用,做题时注意影响平衡移动的因素以及平衡常数的有关计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
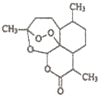 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
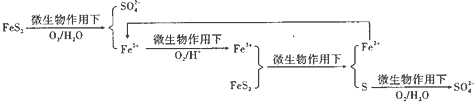
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com