
【题目】下列关于核外电子排布的说法中不正确的是( )
A. 第n电子层最多可容纳的电子数为2n2
B. 次外层中最多可容纳的电子数为18
C. 最多可容纳2个电子的电子层一定是第一电子层
D. 最多可容纳8个电子的电子层一定是第二电子层
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.为了实验验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
(1)以上两实验方案实验现象较为明显的是_____________。
(2)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因_________________。
Ⅱ. (3) 向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________。
Ⅲ.利用如图装置可验证同主族元素非金属性的变化规律。
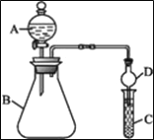
(4)仪器B的名称为__________,干燥管D的作用是__________________。
(5)若要证明非金属性: Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉—碘化钾混合溶液,观察到C中溶液_____________________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(6)若要证明非金属性: C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液______________________(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
【答案】B
【解析】
A.过氧化钠的电子式为![]() ,则7.8g过氧化钠含有的共用电子对为
,则7.8g过氧化钠含有的共用电子对为![]() ×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
【题型】单选题
【结束】
19
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
【答案】C
【解析】
试题A.b点表示NH4HSO4溶液与NaOH溶液恰好反应生成硫酸钠、硫酸铵,溶液显酸性,离子浓度由大到小的顺序为:c(Na+)=c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH
)>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(OH-),故D错误;故选C。
)+c(OH-),故D错误;故选C。
考点:考查了弱电解质的电离平衡、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
20
【题目】下列有关电解质溶液的说法正确的是
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们生活中处处都与化学有密切关系。
(1)洪灾过后,饮用水可用漂白粉消毒。
①工业上将氯气通入石灰乳 [Ca(OH)2]中制取漂白粉,反应的化学方程式为_______________________。
②Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为3Cl2(g)+8NH3(g)=6NH4Cl+N2(g),若反应中消耗Cl21.5mol,则被氧化的NH3的体积为_______________________L(标准状况)。
(2)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。
①电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:______________________________________________;如何检验FeCl3腐蚀铜后的溶液是否含Fe3+_______________________________________。
②高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应:![]() ,下列各条件的叙述中,能表明反应已达,平衡状态的是( )
,下列各条件的叙述中,能表明反应已达,平衡状态的是( )
A. 各物质的物质的量浓度比为2:1:1
B. 压强保持不变的状态
C. 断裂2 mol H-I键的同时生成1 mol I-I键
D. 混合物中各组成成分的含量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
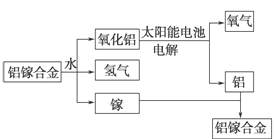
A. 该过程中,能量的转化形式只有两种
B. 铝镓合金可以循环使用
C. 铝镓合金与水反应的化学方程式为:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
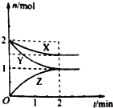
(1)n=______;
(2)Y的平衡浓度为_______;
(3)反应开始至平衡,X 的反应速率v(X)=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
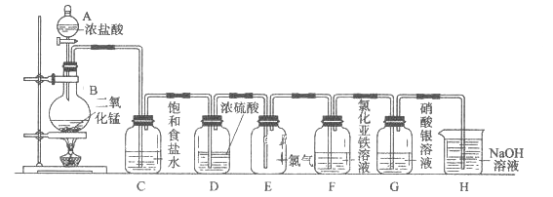
(1)A中盛有浓盐酸,B中盛有MnO![]() ,则烧瓶中发生反应的化学方程式为:______。
,则烧瓶中发生反应的化学方程式为:______。
(2)C中盛有饱和食盐水,其作用是_________,装置D的作用_________。
(3)装置E中气体的颜色为_______,E中Cl![]() 能使湿润的红色布条褪色的原因是________。
能使湿润的红色布条褪色的原因是________。
(4)F中是FeCl![]() 溶液,现象是________,发生反应的离子方程式为__________。
溶液,现象是________,发生反应的离子方程式为__________。
(5)G中是AgNO![]() 溶液,现象是___________,有关化学反应的离子方程式为_________。
溶液,现象是___________,有关化学反应的离子方程式为_________。
(6)H中盛有NaOH溶液,其作用是_______,发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
选项 | 被提纯物质 | 杂质 | 除杂试剂或方法 |
A | FeCl3溶液 | FeCl2 | 通入适量Cl2 |
B | Cl2 | H2O (蒸气) | 通入浓硫酸中 |
C | 铜粉 | 铁粉 | 加入过量盐酸并过滤 |
D | CO2 | HCl | 通入饱和的碳酸钠溶液中 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com