解:(1)乙醇能够被氧化为乙醛,然后乙醛可继续被氧化为乙酸,则C为乙酸,其结构简式为CH
3COOH,反应①的化学方程式为2CH
3CH
2OH+O
2
2CH
3CHO+2H
2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;
故答案为:CH
3COOH;2CH
3CH
2OH+O
2
2CH
3CHO+2H
2O;A;
(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS
2,FeS
2能燃烧生成SO
2,SO
2催化氧化生成SO
3,反应②的化学方程式为2SO
2+O
2
2SO
3,
故答案为:FeS
2;2SO
2+O
2
2SO
3;
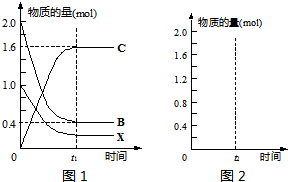
①由图1可知,参加反应的B的物质的量为1.6mol,则B的转化率为

×100%=80%,故答案为:80%;
②由图1可知,平衡时,C
B=
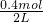
=0.2mol/L,C
X=

=0.1mol/L,C
C=

=0.8mol/L,所以K=

=160,故答案为:160;
③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,平衡时X的物质的量为0.2mol,B的物质的量为0.4mol,C的物质的量为1.6mol,如图所示,

故答案为:

分析:(1)乙醇能够被氧化为乙醛,然后乙醛可继续被氧化为乙酸;乙醇汽油属于混合物;
(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS
2,FeS
2能燃烧生成SO
2,SO
2催化氧化生成SO
3;
①由图可知,参加反应的B的物质的量为1.6mol,以此计算转化率;
②根据平衡时各物质的浓度及K的定义式来计算;
③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,以此来作图.
点评:本题考查无机物的推断及化学平衡的计算,明确乙醇的性质及工业制硫酸的反应、化学平衡常数、转化率的计算即可解答,注意等效平衡的应用来解答最后一问,题目难度不大.


 2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;
2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的; 2CH3CHO+2H2O;A;
2CH3CHO+2H2O;A; 2SO3,
2SO3, 2SO3;
2SO3; ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%; =0.2mol/L,CX=
=0.2mol/L,CX= =0.1mol/L,CC=
=0.1mol/L,CC= =0.8mol/L,所以K=
=0.8mol/L,所以K= =160,故答案为:160;
=160,故答案为:160;






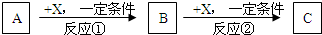

 现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
