
| A. | 升高温度,上述反应的平衡常数增大 | |
| B. | 其他条件不变,压缩容器,V正、V逆均增大 | |
| C. | 保持容器的容积不变,向密闭容器中充入CO2,平衡逆向移动 | |
| D. | 保持体系的压强不变,向密闭容器中充入氦气,平衡正向移动 |
分析 A、正反应是放热反应,温度越高平衡常数越小;
B、增大压强,正逆反应速率都加快;
C、增大反应物的浓度平衡正向移动;
D、保持体系的压强不变,向密闭容器中充入氦气,相当于减小压强,平衡向气体体积增大的方向移动.
解答 解:A、正反应是放热反应,升高温度平衡常数减小,故A错误;
B、增大压强,正逆反应速率都加快,所以压缩容器,V正、V逆均增大,故B正确;
C、保持容器的容积不变,向密闭容器中充入CO2,增大反应物二氧化碳的浓度平衡正向移动,故C错误;
D、保持体系的压强不变,向密闭容器中充入氦气,相当于减小压强,平衡向逆反应方向移动,故D错误;
故选B.
点评 本题考查影响化学反应速率的因素、化学平衡常数的影响因素和外界条件对平衡移动的影响,综合性强,难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2充足时,SO2可全部转化为SO3 | |
| B. | 加入催化剂是为了加快反应速率 | |
| C. | 达到化学平衡时SO2和SO3的浓度相等 | |
| D. | 达到化学反应限度时,反应停止进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| B. | c(NH4+)相等的(NH4)2C03、(NH4)2S04和(NH4)2Fe(S04)2三份溶液中,溶质物质的量浓度依 次增大 | |
| C. | 在 0.lmol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2C03) | |
| D. | 常温下,CH3COONa和 CH3COOH 混合溶液[pH=7,c(Na+)=0.1mol•L-1];c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1molH2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
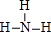 (填结构式);
(填结构式);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com