
在恒温时,向某密闭容器中通入2 mol X和1 mol Y气体,发生如下反应:2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。?
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。?
(1)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和2 mol Y(g),达到平衡,则Z的体积分数为_______;平衡时,气体X的体积分数为_______。?
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则![]() 的取值范围为_______。
的取值范围为_______。
科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H
CH3OH(g)△H| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NO(g)△H>0
2NO(g)△H>0| c2(NO) |
| c(N2)?c(O2) |
| c2(NO) |
| c(N2)?c(O2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |
| (3×10-3 )2 |
| (2.5×10-1)×(4.0×10-2) |

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南周口重点高中四校高二下学期第一次联考化学卷(带解析) 题型:填空题
(12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |

查看答案和解析>>
科目:高中化学 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:填空题
(12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g)
△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g)
△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
|
浓度/mol•L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数)
②30min后,改变某一条件,经过一段时间后反应重新达到平衡,则改变的条件可能是
③若30min后升高温度至T2℃,达到平衡时,容器中的NO、N2、CO2的浓度之比为5:3:3,则该反应的△H (填“>”、“<”或“=”)0
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H20(g) △H=-574kJ.mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ.mol-1
③H2O(g)=H2O(l) △H=-44.0kJ.mol-1
写出CH4和NO2反应生成N2(g) 、CO2(g)和 H2O(l)的热化学方程式:
(3)选择性催化还原(SCR)脱硝技术是目前应用最广、最有效的烟气脱硝技术之一。该技术涉及以下反应:4NO(g)+4NH3(g)+ O2(g)=在4N2(g)+ 6H2O(g),在恒容的密闭容器中,下列有关说法中正确的是 (填字母)
A.其他条件不变,使用高效催化剂,烟气中NO的转化率增大
B.单位时间内消耗NH3和NO的物质的量之比为1:1时,反应达到平衡
C.其他条件不变时升高温度,反应的平衡常数减小
D.反应达到平衡后,再向容器中充入等量的反应物,再次达到平衡时,NO的转化率减小
(4)以NO2 、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,该电极的电极反应可表示为

查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:填空题
(15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
①下列各项不能作为判断反应达到化学平衡状态依据的是
A.容器内CO2 的浓度保持不变 B.v正(N2) =2 v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②T1℃时,该反应的平衡常数K= (保留两位小数)。
③30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
④若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
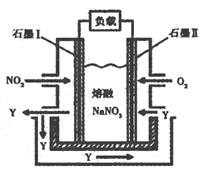
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com