
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
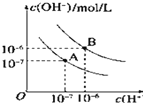
(1)95℃时,0.01mol/LNaOH溶液的pH=________________________________________
(2)95℃时水的电离平衡曲线应为_________(填“A”或“B”),请说明理由___________
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________________________________________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________
(5)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:___________________________________________________
【答案】10 B 水的电离是吸热过程,温度升高电离程度增大,c(H+)、c(OH-)均增大 10:1 a+b=14 或pH1+pH2=14 曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
【解析】
由于水的电离是吸热过程,升高温度,促进水的电离,c(H+)、c(OH-)均增大,则A曲线代表25℃,B曲线代表95℃,且25℃时水的离子积Kw=10-14,95℃时水的离子积Kw=10-12。
(1)95℃时,![]() 溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为
溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为![]() ,溶液的pH=10;
,溶液的pH=10;
(2)水的电离是吸热过程,温度升高,水的电离程度增大,![]() 、
、![]() 均增大,所以B曲线代表95℃;
均增大,所以B曲线代表95℃;
(3)25℃时所得混合溶液的pH=7,溶液呈中性,酸碱恰好中和,即硫酸溶液中n(H+)与NaOH溶液中n(OH-)相等,则![]()
![]()
![]() ,得
,得![]() ;
;
(4)95℃时水的离子积为![]() ,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10-a×100=10b-12×1,解得
,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10-a×100=10b-12×1,解得![]() 即pH1+pH2=14;
即pH1+pH2=14;
(5)在曲线B对应温度下,pH=2的HA溶液中c(H+)=10-2mol/L,pH=10的NaOH溶液中c(OH-)=10-2mol/L,两者等体积混合后溶液的pH=5,说明混合后溶液呈酸性,由于NaOH为强碱,则说明HA为弱酸,两者充分反应后HA过量,过量的HA继续电离出H+,溶液呈酸性。


科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
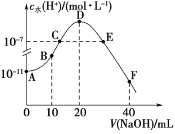
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知:![]() (橙色)+ H2O
(橙色)+ H2O![]() (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
序号 | 操作 | 现象 |
i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
ii | 配制0.05 mol·L1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
序号 | 操作 | 现象 |
iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
序号 | 操作 | 现象 |
v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
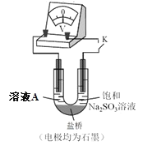
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
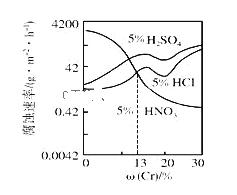
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
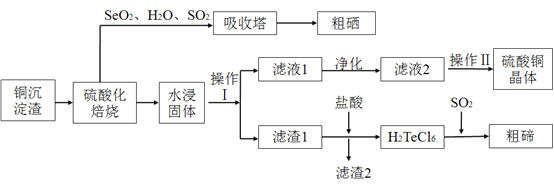
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
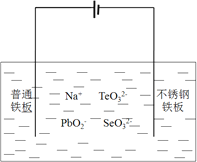
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
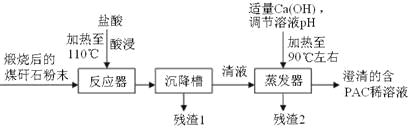
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com