
【题目】二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组由二氧化氯制备亚氯酸钠,并探究其性质的实验如下。
(资料査阅)①SO2可将 NaClO3还原为ClO2;② NaClO2酸化生成NaCl,并放出ClO2

实验步骤如下
I.组装仪器并检查气密性。仪器组装完毕(如图所示),关闭①②③三个止水夹及b活塞,打开a的活塞,向A的圆底烧瓶中注入水,检查装置的气密性。
Ⅱ.制备亚氯酸钠。在各装置中分别加入相应的试剂,关闭止水夹①③和b的活塞,打开止水夹②及a的活塞,向A的圆底烧瓶中滴入75%硫酸。
III.探究亚氯酸钠的性质。打开止水夹①和②,关闭止水夹③和a的活塞,通入一段时间空气;关闭止水夹①和②,打开止水夹③和b的活塞,向C的三颈烧瓶中滴入稀硫酸。
试回答下列问题
(1)步骤1中,装置气密性良好的现象是_________;仪器a或b在使用前应________。
(2)步骤Ⅱ中,B中反应的化学方程式为________,C中H2O2的作用为_______。
(3)步骤Ⅲ中,先通入一段时间空气的目的是________,试管D中的现象为_______。
(4)步骤Ⅲ中,开始时C中反应缓慢,稍后产生气体的速率却迅速加快。试解释可能的原因_____________________。
(5)步骤II,实验前若向C三颈烧瓶中加入25mL8.0mol/LH2O2溶液反应,分离提纯得到18.88gNaClO2晶体,则H2O2的有效利用率为________(保留两位有效数字)。
【答案】一段时间后,仪器a中液面不再下降 检查是否漏水 SO2+2NaClO3=2ClO2+Na2SO4 H2O2作还原剂 排出装置中残留的ClO2、SO2气体,避免干扰实验 溶液由无色变蓝色 反应生成的Cl-起催化作用(或:该反应放热使温度升高,反应速率加快) 52%
【解析】
(1) 若装置不漏气,因装置中气体压强增大,a中液体不能顺利流下;根据分液漏斗的使用方法回答。
(2)步骤Ⅱ,B中SO2将 NaClO3还原为ClO2,C中用二氧化氯制备亚氯酸钠,ClO2发生还原反应。
(3) 装置中残留的ClO2、SO2气体干扰NaClO2的检验;C中加入硫酸生成的ClO2与 D试管中的KI反应生成碘单质。
(4)根据影响反应速率的因素分析。
(5)C中的反应方程式是2ClO2+2NaOH+H2O2=2NaClO2+O2↑+2H2O,根据方程式计算H2O2的有效利用率。
(1) 若装置不漏气,因装置中气体压强增大,a中液体不能顺利流下,所以现象是一段时间后,仪器a中液面不再下降;仪器a、b是分液漏斗,使用前要检验是否漏水;
(2) 步骤Ⅱ,B中SO2将 NaClO3还原为ClO2,反应的化学方程式为SO2+2NaClO3=2ClO2+Na2SO4,C中用二氧化氯制备亚氯酸钠,ClO2发生还原反应,H2O2作还原剂。
(3) 装置中残留的ClO2、SO2气体干扰NaClO2的检验,骤Ⅲ中,先通入一段时间空气的目的是排出装置中残留的ClO2、SO2气体,避免干扰实验;C中加入硫酸生成的ClO2与D试管中的KI反应生成碘单质,所以试管D中的现象为溶液由无色变蓝色。
(4) NaClO2酸化生成NaCl,反应生成的Cl-起催化作用;NaClO2与硫酸的反应放热使温度升高,反应速率加快。
(5)设参加反应的H2O2的物质的量是xmol;
2ClO2+2NaOH+H2O2=2NaClO2+O2↑+2H2O,
1mol 181g
xmol 18.88g
X≈0.104mol,H2O2的有效利用率为![]() 52%。
52%。


科目:高中化学 来源: 题型:
【题目】300 ℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 前2 min的平均反应速率v(X)=2.0×10-2 mol/(L·min)
B. 该反应在300 ℃时的平衡常数为1.44
C. 当v逆(Y)=2v正(Z)时,说明反应达到平衡
D. 其他条件不变,再充入0.1 mol X和0.1 mol Y,再次平衡时Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水Na2SO3固体配制 250 mL 0.1000 mol·L-1溶液的步骤如下图,请回答:

(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、天平和____________;
(2)下列操作不会使配得的Na2SO3溶液浓度偏低的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
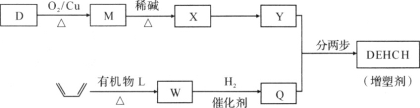
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,单质只作氧化剂的是
A.2F2+2H2O═4HF+O2↑
B.Cl2+2NaOH═NaCl+NaClO+H2O
C.2Na+2H2O═2NaOH+H2↑
D.H2+CuO![]() H2O+Cu
H2O+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮、硫污染物的治理是环保的一项重要工作。
(1)①N2(g)+O2(g)═2NO(g) △H1
②2C(s)+O2(g)═2CO(g) △H2
③C(s)+O2(g)═CO2(g) △H3
则2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_______________(用△H1、△H2、△H3表示)。
(2)工业上常用醋酸二氨合亚铜 [Cu(NH3) 2] AC溶液(AC为CH3COO-)来吸收某合成气中的CO,其反应为:[Cu(NH3) 2] AC(aq)+NH3(g)+CO(g) ![]() [Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
[Cu(NH3)3] AC CO(aq) △H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是________________;
(3)用天然气制取H2的其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g) 。在密闭容器中通入物质的量均为0.1mol的CH4与CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:压强P1_____P2(填 “大于”或“小于”),理由是____________________,压强为P2时,在Y点:v(正)_________v(逆)(填“大于”、“小于”或“等于”)。

(4)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离平衡常数Ka=9.6×10﹣4,NaNO2溶液中存在平衡NO2- +H2O![]() HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
HNO2 +OH- 其水解平衡常数Kh=5.0×10﹣11 则该温度下水的离子积常数KW=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以LiPF6和SO(CH3)2为电解质的高能锂电池的总反应式为2Li+FeS=Fe+LiS,用该电池为电源进行如图的电解实验,电解一段时间测得甲电池产生标准状况下H24.48L。下列有关叙述正确的是

A. Y电极为高能锂电池的负极从隔膜中通过的离子数目为0.4NA
B. 电解池中换成阴离子交换膜,总反应不发生变化
C. 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
D. 电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com