
| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:实验题
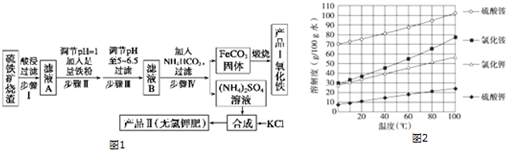
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
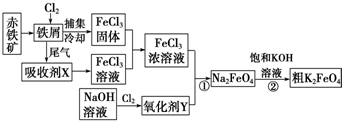
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
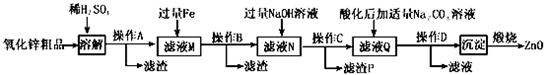
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳用于灭火 | B. | 氧气供给呼吸 | ||
| C. | 金刚石用作钻探机的钻头 | D. | 用镁制作照明弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000wd}{M(w+1000)}$ mol•L-1 | B. | $\frac{wd}{Mw+1000}$mol•L-1 | ||
| C. | $\frac{w}{M}$mol•L-1 | D. | $\frac{1000wd}{wM+1000}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com