
 =0.3mol/L;
=0.3mol/L; ×100%=80%;
×100%=80%; =0.6mol/(L?min),
=0.6mol/(L?min),

科目:高中化学 来源: 题型:
 熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.
熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.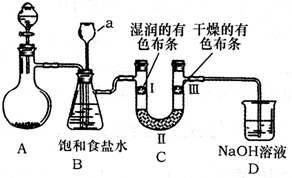
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.用10 mL量筒准确量取稀硫酸溶液8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体
F.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)用50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行中和热的测定实验,请回答下列问题:
①在实验中使用的仪器除大烧杯、小烧杯、环形玻璃搅拌棒、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)外,还必须要用到的仪器有___________________________。
②要想提高中和热测定的准确性,可采用的措施除以下列出的三种以外,请你再写出三种:
a.如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平。
b.盐酸和NaOH溶液浓度的配制要准确,且NaOH溶液的浓度须稍大于盐酸的浓度。
c.实验操作时动作要快,注意不要将溶液洒到外面。
d.__________________________________________________________。
e.__________________________________________________________。
f.__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江大庆实验中学高三上学期期中考试化学试卷 题型:实验题
(1)下列有关实验的说法、操作或结论不正确的是 (填序号)
| A.制备Fe(OH)3胶体时,应往沸水中滴加饱和FeCl3溶液,并继续加热到溶液呈红褐色为止。 |
| B.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液的起始温度和反应后溶液的最高温度。 |
| C.在一定物质的量溶液配制的过程中,没有洗涤烧杯和玻璃棒、定容时加水超过了刻度线、容量瓶没有干燥均会使所配溶液浓度偏低。 |
| D.往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com