
 现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L,回答下列问题:
现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L,回答下列问题:分析 设CO和CO2的物质的量分别为xmol、ymol,则列方程组$\left\{\begin{array}{l}{28x+44y=21.6}\\{x+y=\frac{13.44}{22.4}}\end{array}\right.$计算CO和CO2物质的量,进而可计算混合气体的平均摩尔质量、碳原子的质量,将混合气体依次通过如图所示装置,二氧化碳与氢氧化钠反应,经浓硫酸干燥,得到的气体为CO,以此解答该题.
解答 解:设CO和CO2的物质的量分别为xmol、ymol,则列方程组$\left\{\begin{array}{l}{28x+44y=21.6}\\{x+y=\frac{13.44}{22.4}}\end{array}\right.$,解之得x=0.3,y=0.3,气体共为0.6mol,则
(1)该混合气体的平均摩尔质量为$\frac{21.6g}{0.6mol}$=36g/mol,故答案为:36g/mol;
(2)CO和CO2中碳原子的质量为0.6mol×12g/mol=7.2g,故答案为:7.2g;
(3)将混合气体依次通过如图所示装置,二氧化碳与氢氧化钠反应,经浓硫酸干燥,得到的气体为CO,
①气球中收集到的气体为CO,摩尔质量为28g/mol,故答案为:28g/mol;
②0.3molCO含有的电子数为0.3mol×(6+8)×NA/mol=4.2NA,故答案为:4.2NA;
③V=0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及相关计算公式的运用,难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;I→J
+NaCl;I→J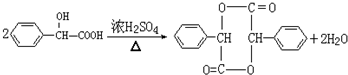 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水成为硅酸 | |
| B. | CO2通入水玻璃中得到白色沉淀 | |
| C. | CO2通入饱和CaCl2溶液能生成白色沉淀 | |
| D. | 硅酸酸性比碳酸弱,所以SiO2不能跟Na2CO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
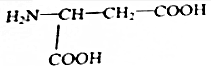 (5)
(5)
| A. | 二肽 | B. | 三肽 | C. | 四肽 | D. | 五肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com