
 ②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
| A. | ①⑤ | B. | ①②④⑥ | C. | ①④ | D. | ①③⑥ |
分析 有机物能够使酸性高锰酸钾溶液褪色,说明分子中含有不饱和键(碳碳双键、碳碳三键)或羟基、醛基等还原性官能团,据此进行解答.
解答 解:① 为新戊烷,烷烃不能使酸性高锰酸钾溶液褪色,故①正确;
为新戊烷,烷烃不能使酸性高锰酸钾溶液褪色,故①正确;
②乙烯分子中含有碳碳双键,能够使酸性高锰酸钾溶液褪色,故②错误;
③CH3COOH为乙酸,不与酸性高锰酸钾溶液反应,则不能使酸性高锰酸钾溶液褪色,故③正确;
④CH3CH2OH为乙醇,含有的醇羟基能够被酸性高锰酸钾溶液氧化,能够锰酸钾溶液褪色,故④错误;
⑤CH2═CH-COOH中含有的碳碳双键能够使酸性高锰酸钾溶液褪色,故⑤错误;
⑥ 为苯,苯不与酸性高锰酸钾溶液反应,故⑥正确;
为苯,苯不与酸性高锰酸钾溶液反应,故⑥正确;
故选D.
点评 本题考查常见有机物结构与性质,题目难度不大,明确常见有机物含有官能团结构与性质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
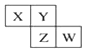 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W、Z对应的最高价氧化物对应的水化物的相对分子质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
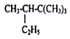 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷; 表示的分子式为C4H7Cl;
表示的分子式为C4H7Cl;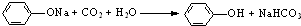 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
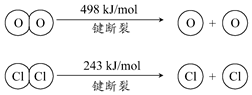 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:| A. | 升高温度能提高HCl的转化率 | |
| B. | 加入催化剂,能使该反运的焓变减小 | |
| C. | 1molCl2转化为2molCl原子放出243kJ热量 | |
| D. | 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com