
分析 根据反应热△H=反应物的总键能-生成物的总键能计算,以此解答该题.
解答 解:已知:H-H键能为436kJ•mol-1,N-H键键能为391kJ•mol-1,令N≡N的键能为x,
对于反应N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.
反应热△H=反应物的总键能-生成物的总键能,故x+3×436kJ•mol-1-2×3×391kJ•mol-1=-92.4kJ•mol-1
解得:x=945.6kJ•mol-1,
故答案为:945.6.
点评 本题考查了反应热的有关计算、反应热与化学键键能的关系,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,明确反应热与键能的关系是解答本题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
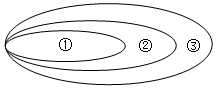
| A. | ①CO、②酸性氧化物、③氧化物 | B. | ①Na2CO3、②钠盐、③碳酸盐 | ||
| C. | ①胶体、②分散系、③混合物 | D. | ①单质、②化合物、③纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰熔化时只破坏范德华力而不破坏共价键 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 氢键存在于分子之间,也存在于分子之内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(苯) | |
| B. | MgCl2酸性溶液中少量的FeCl3(Mg(OH)2) | |
| C. | 硝基苯中的苯(硝酸) | |
| D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
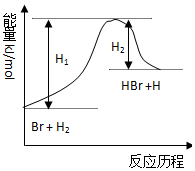
| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不改变 | |
| C. | 逆反应为吸热反应 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+Mg2+ CO32-Cl- | B. | Fe3+Cl- Na+H+ | ||
| C. | H+ Ag+ NO3- NH4+ | D. | CO32-H+Na+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com