
【题目】下列物质中含有非极性共价键的离子化合物是( )
A.Cl2
B.Na2O2
C.H2O2
D.MgCl2
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是
A. 乙醇可用作燃料 B. 碳酸钠可用来治疗胃酸分泌过多
C. 明矾可用作净水剂 D. 食醋可用于除去暖水瓶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在大量的OH-、SO42-、Na+,该溶液中还可能大量存在的离子是
A. NH4+ B. A1O2- C. Cu2+ D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④该反应的焓变ΔH_________0(填“>”、“=”或“<”)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
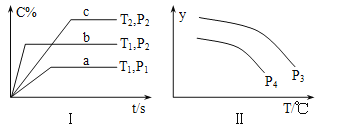
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
C. 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023
D. 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电。电池的工作原理为:LiMO2+nC![]() Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示。下列有关说法正确的是
Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示。下列有关说法正确的是
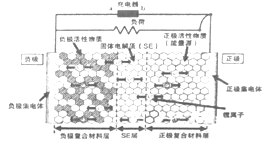
A. 电池放电时,负极发生的反应为:nC+xLi++xe-=LixCn
B. 充电器的a 端接电源的负极,b端接电源的正极
C. 电池充电时Li+自左向右移动
D. 电池工作时,固体电解质因熔融而导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 molL﹣1s﹣1 B.v(B)=0.5 molL﹣1s﹣1
C.v(C)=0.8 molL﹣1s﹣1 D.v(D)=60 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
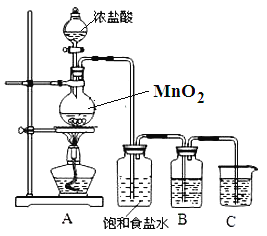
(1)装置B中盛放的试剂是_____(填选项),实验现象为_____,化学反应方程式是_____.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是_____.
(3)能证明氯元素比硫元素非金属性强的依据为_____. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2﹣比Cl﹣还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象_____,写出反应的离子方程式_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com