
A、工业合成氨:N2+3H2
| |||
B、工业合成盐酸:H2+Cl2
| |||
C、工业获取氯化钠:2Na+Cl2
| |||
D、工业制取氯气:2NaCl+2H2O
|


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C、正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动 |
| D、逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:Sn4+<Sn2+ |
| B、氧化性:Fe3+<Sn4+ |
| C、还原性:Fe2+<Sn2+ |
| D、还原性:Fe<Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、FeCl2酸性溶液放在空气中变质:4Fe2++4H++O2=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
131 53 |
137 55 |
A、每个
| ||
| B、CsOH的碱性比NaOH弱 | ||
| C、KIO3是碘的最高价氧化物的水化物的盐 | ||
| D、I-比F-还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
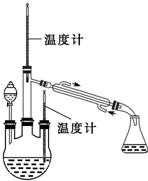 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液. | 出现白色沉淀,说明菠菜中 |
| 步骤2:取步骤1的沉淀于试管中,加入足量 | |
| 步骤3:向步骤2得到的溶液中滴加几滴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com